一、原子的构成
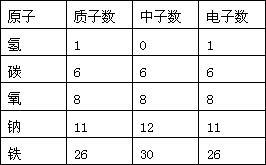
几种原子的构成
1.原子(中性) (一个质子带一个单位的正电荷)中子(不带电)
核外电子(一个电子带一个单位的负电荷)
2.原子不显电性的原因:原子核内质子所带电荷与核外电子的电荷数量相等,电性相反,因此原子不显电性。
3.构成原子的各种粒子之间的质量关系:原子的质量主要集中在原子核上,即原子质量=质子质量+中子质量(电子质量可以忽略不计)
4.构成原子的各种粒子之间的数量关系
(1)在原子里,原子序数=核电荷数=质子数=核外电子数,
(2)质子数不一定等于中子数,如普通氢原子核内无中子。
(3)同种原子的质子数相同,不同种原子的质子数不同。
二、相对原子质量:(符号为Ar)
1.相对原子质量=某原子的质量/一种碳原子质量的1/12
2.相对原子质量=质子数+中子数
3.我国科学院院士张青莲教授为相对原子质量的测定做出了卓越的贡献,他主持测定了铟、铱、锑、铈、铕、铒、锗、锌、镝几种元素的相对原子质量的新值、被国际原子量委员会釆用为相对原子质量数据标准。
三、核外电子的排布
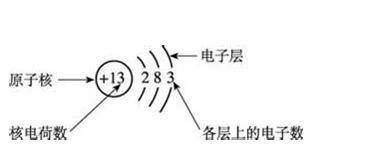
1.核外电子排布的规律:
(1)核外电子总是尽先排在能量低的电子层,排满之后再逬人能量高的电子层
(2)第一层最多容纳2个电子,第二层最多容纳8个电子。
(3)最外层电子数不超过8个(第一层是最外层时,不能超过2个电子)
2.不同类元素的原子最外层电子数特点;
金属元素的原子:最外层电子数一般少于4个,易失电子形成阳离子,
非金属元素的原子:最外层电子数一般多于4个,易得电子形成阴离子
稀有气体元素的原子:最外层电子数为8( He为2),不易得失电子
3.相对稳定结构:最外层电子数为8(若第一层为最外层时,电子数为2 )的结构
4.元素的化学性质由原子的最外层电子数决定。
一般当两种原子的最外层电子数相同,则这两种元素的化学性质相似。
特殊说明:最外层电子数相同的原子,其元素化学性质不一定都相同 (Mg,He最外层电子数都为2,但化学性质不同 。Na,H最外层电子数都为1,但化学性质不同)
最外层电子数不同的原子,其化学性质有可能相似 (He,Ne均为相对稳定结构,化学性质相似)
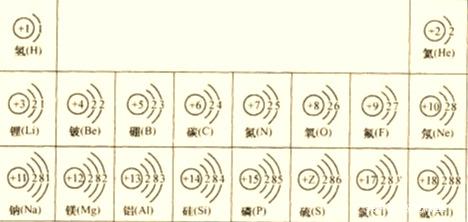
部分原子的结构示意图
四 、离子
1.概念:帯电的原子或原子团
2.分类及形成:阳离子:(由于原子失去电子而形成)带正电
阴离子:(由于原子得到电子而形成)带负电
注意:原子在变为离子时,质子数没有改变:
电子数、最外层电子数、化学性质发生了改变;
电子层数可能改变。
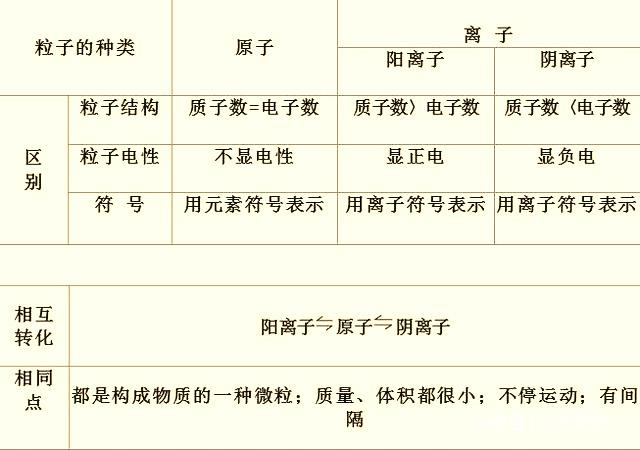
3.离子与原子的区别与联系
4.离子符号前面的数字:表示离子的个数。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论