
1、定义:表明反应所放出或吸收的热量的方程式,叫做热化学方程式。
2、热化学方程式书写注意事项:
(1).△H只能写在标有反应物和生成物状态的化学方程式的右边,并用“;”隔开。若
为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/mol。
(2).注意反应热△H与测定条件(温度.压强等)有关。因此书写热化学方程式时应注
明△H的测定条件绝大多数△H是在25℃.101325Pa下测定的,可不注明温度和压强。
(3).注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,
并不表示物质的分子 或原子数。因此化学计量数可以是整数.也可以是分数。
(4).注意反应物和产物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚
集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用↑和↓
(5).注意热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。
(6)当反应逆向进行时,反应热数值相等,符号相反;两个热化学方程式相加或相减,可得到新的热化学方程式。
(7) ΔH的单位“kJ·mol-1”的含义。并不是指每摩尔具体物质反应时伴随的能量变化是多少千焦,而是指给定形式的具体反应以各物质的化学计量数来计量其物质的量时伴随的能量变化。如2H2(g) + O2(g) = 2H2O(g) ΔH =-483.6 kJ·mol-1中的反应热是指每摩尔反应[2H2(g) + O2(g) = 2H2O(g)],放出的热量为483.6 kJ。因此ΔH与化学反应方程式的写法有关,例如:H2(g) + 1/2 O2(g) = H2O(g) ΔH =-241.8 kJ·mol-1。
(8)不论化学反应是否可逆,热化学方程式中的反应热△H表示反应进行到底(完全转化)时的能量变化。如:2SO2(g)+O2(g)=2SO3(g) ΔH=-197 kJ·mol-1,是指2 mol SO2(g)和1 mol O2(g)完全转化为2 mol SO3(g)时放出的能量。若在相同的温度和压强时,向某容器中加入2 mol SO2(g)和1 mol O2(g)反应达到平衡时,放出的能量为Q,因反应不能完全转化生成2 mol SO3(g),故Q<197 kJ。
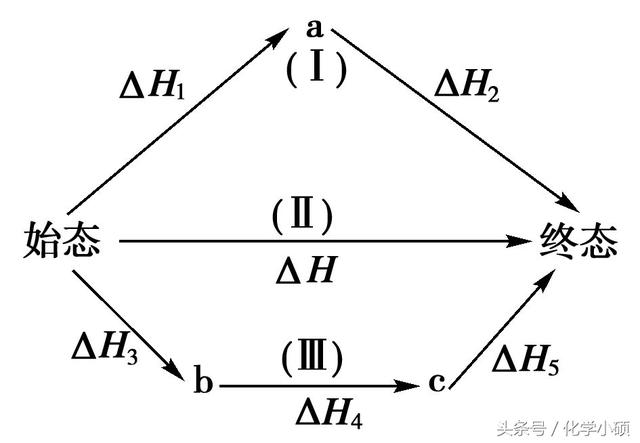
3.热化学方程式的计算类型
⑴根据热化学方程式进行计算
①一般计算的方法是:将ΔH看作热化学方程式中的一项,再按有关化学方程式的计算步骤、格式进行计算,得出有关数据。
②盖斯定律的应用:如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
⑵反应热的大小比较
①同一反应中,生成物状态不同
如:A(g)+B(g) = C(g) ΔH1<0,
A(g)+B(g) = C(l) ΔH2<0,
因为产物C(g)比C(l)所含能量多,反应放出热量少。
②同一反应中,反应物状态不同
如:S(g)+O2(g) = SO2(g) ΔH1<0,
S(s)+O2(g) = SO2(g) ΔH2<0
因为反应物S(g)比S(s)所含能量多,所以反应放出热量就

 加载中,请稍侯......
加载中,请稍侯......
精彩评论