应用有机物的物理性质和化学性质实现有机物的分离典型例子:
1.乙烷(乙烯)
错例A:通入氢气,使乙烯反应生成乙烷。
错因:①无法确定加入氢气的量;②反应需要加热,并用镍催化,不符合“操作简单”原则。
错例B:通入酸性高锰酸钾溶液,使乙烯被氧化而除去。
错因:乙烯被酸性高锰酸钾溶液氧化可生成二氧化碳气体,导致新的气体杂质混入。
正解:将混合气体通入溴水洗气,使乙烯转化成1,2-二溴乙烷液体留在洗气瓶中而除去。
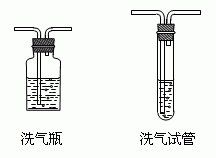
洗气
2.乙醇(水)
错例A:蒸馏,收集78℃时的馏分。
错因:在78℃时,一定浓度(95.57%)的乙醇和水会发生“共沸”现象,即以恒定组成共同气化,少量水无法被蒸馏除去。
错例B:加生石灰,过滤。
错因:生石灰和水生成的氢氧化钙能溶于乙醇,使过滤所得的乙醇混有新的杂质。
正解:加生石灰,蒸馏。(这样可得到99.8%的无水酒精)。
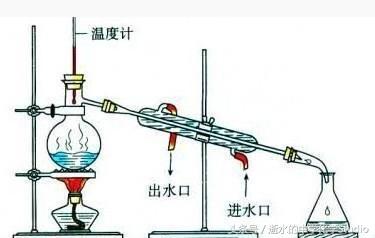
蒸馏
3.乙醇(乙酸)
错例A:蒸馏。(乙醇沸点78.5℃,乙酸沸点117.9℃)。
错因:乙醇、乙酸均易挥发,且能形成恒沸混合物。
错例B:加入碳酸钠溶液,使乙酸转化为乙酸钠后,蒸馏。
错因:乙醇和水能形成恒沸混合物。
正解:加入适量生石灰,使乙酸转化为乙酸钙后,蒸馏分离出乙醇。
4.溴乙烷(乙醇)
错例:蒸馏。
错因:溴乙烷和乙醇都易挥发,能形成恒沸混合物。
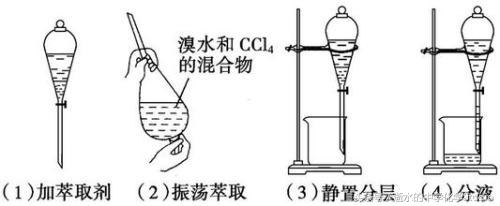
正解:加适量蒸馏水振荡,使乙醇溶于水层后,分液。
5.苯(甲苯)[或苯(乙苯)]
错例:加酸性高锰酸钾溶液,将甲苯氧化为苯甲酸后,分液。
错因:苯甲酸微溶于水易溶于苯。
正解:加酸性高锰酸钾溶液后,再加氢氧化钠溶液充分振荡,将甲苯转化为易溶于水的苯甲酸钠,分液。
6.苯(溴)[或溴苯(溴)]
错例:加碘化钾溶液。
错因:溴和碘化钾生成的单质碘又会溶于苯。
正解:加氢氧化钠溶液充分振荡,使溴转化为易溶于水的盐,分液。
7.乙酸乙酯(乙酸)
错例A:加水充分振荡,分液。
错因:乙酸虽溶于水,但其在乙酸乙酯中的溶解度也很大,水洗后仍有大量的乙酸残留在乙酸乙酯中。
错例B:加乙醇和浓硫酸,加热,使乙酸和乙醇发生酯化反应转化为乙酸乙酯。
错因:①无法确定加入乙醇的量;②酯化反应可逆,无法彻底除去乙酸。
错例C:加氢氧化钠溶液充分振荡,使乙酸转化为易溶于水的乙酸钠,分液。
错因:乙酸乙酯在氢氧化钠溶液中容易水解。
正解:加饱和碳酸钠溶液(乙酸乙酯在饱和碳酸钠溶液中的溶解度较小),使乙酸转化为钠盐溶于水层后,分液。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论