很多初三学生学习完酸碱盐后,总感觉化学真难!记不住酸碱盐有哪些化学性质,很多方程式都不知怎么写,什么题都难!错的也是一塌糊涂!是的,酸碱盐不好学,有句话叫做“学好酸碱盐,化学就不难”!
1
1个规律─-交换律
01
直接交换
酸碱盐所发生的反应几乎都是置换反应或者是复分解反应
不论是置换反应还是复分解反应都是位置的交换
例如硫酸铜的两条性质
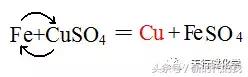
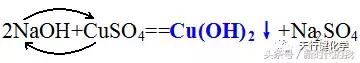
交换一下就写出来了
写方程式前注意熟记化合价。
化合价之歌
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五氮磷
铜一二 铁二三
原子团也要记清
氢氧负一铵正一
酸根所有价为负
一硝二硫碳三磷
置换反应Fe生成亚铁
复分解反应所有元素化合价都不变
①锌和稀硫酸 ②氧化铁和稀盐酸
③氯化钠溶液和硝酸银溶液④硫酸钠溶液和氯化钡溶液
⑤碳酸钠溶液和稀盐酸⑥碳酸钠溶液和石灰水
⑦石灰水和硫酸铜溶液⑧氢氧化钡溶液和稀硫酸
⑨氢氧化钠和硫酸铵共热
即:① 实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
②除铁锈:Fe203+6HCl=2FeCl3+3H20
③检验Cl-离子:NaCl+AgNO3=AgCl↓+NaNO3
④检验SO4-离子:Na2SO4+BaCl2=BaSO4↓+2NaCl
⑤检验CO32-离子:Na2CO3+2HCl=2NaCl+H2O+CO2↑
⑥纯碱制烧碱:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑦波尔多液:Ca(0H)2+CuS04=Cu(0H)2↓+CaS04
⑧中和反应:Ba(0H)2+H2SO4=BaSO4↓+2H20
⑨验NH4+离子:2Na0H+(NH4)2S04ΔNa2SO4+2H2O+2NH3↑
02
非直接交换
先反应后再交换
例如氢氧化钠溶液和二氧化碳的反应 可理解为
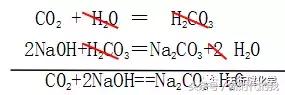
扩展(最重要):1个规则─-必须生成盐的 “必成盐规则”
从以上的化学反应可以看出,所有的反应都生成盐。
酸碱盐的反应大多符合“必成盐”规则:即有酸、碱、盐参加的反应往往会生成盐,否则就是错误的。
如:CuO转化为Cu(OH)2有的写2NaOH+CuO=Cu(OH)2↓+Na2O有沉淀啊
其实不行,氧化物和碱不可以这样反应的,没有这条性质。
可以理解为就是因为没有盐生成,才不反应的。
2NaOH+Al2O3=2NaAlO2(偏铝酸钠)+H2O有盐生成,所以能反应。
根据:“必成盐”规则和“金属离子+酸根组成→盐” 就可以推出酸、碱、盐等的化学性质。如酸的化学性质,因为酸含有酸根,要生成盐必须和含金属元素的物质结合才行,所以酸的化学性质就是能和含金属的物质反应。
含金属的物质共有4种:金属、金属氧化物、碱、盐。所以酸的通性就有和这4类物质起反应。
1
2类反应条件
依据:金属活动性顺序表K Ca Na Mg Al Zn Fe Sn Pd (H) Cu Hg Ag Pt Au
可用谐音趣味记忆法记: 嫁给那美女,心贴(在一起)喜牵情,(牵了多少?)统共一百斤。
01
直接交换
置换反应条件
1:金属+酸的反应条件:
氢前金属、非氧化酸(如:硝酸、浓硫酸具有氧化性,不生成氢气),铁生成亚铁盐。
下列物质间能否反应生成氢气?能反应的写出方程式,不能反应的说明理由。
①Fe+HCl= ②Cu+H2SO4(稀)= ③Fe+2HNO3=
解答:①能Fe+2HCl=FeCl2+H2↑②Cu在H后不反应③HNO3有氧化性不生成氢气
2:金属+盐的反应条件:
前置后,盐须溶,K Ca Na不能行(太活泼,能和水反应)。
下列物质间能否反应置换出金属?能的写出方程式,不能的说明理由。
①Cu+AgNO3= ②Cu+ZnSO4= ③Cu+AgCl= ④Na+CuSO4=
解答:①能Cu+2AgNO3=2Ag+Cu(NO3)2②Cu+ZnSO4≠因为Cu没有Zn活泼③Cu+AgCl≠,因为AgCl不溶于水④2Na+CuSO4≠不生成Cu因为:2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4最终生成的是氢氧化铜沉淀。
02
直接交换
复分解反应的条件
口诀:双交换,价不变,生成气体、水、沉淀;盐-盐、盐-碱须可溶,弱酸制强不能行。
下列物质间能否反应?能反应的写出方程式,不能反应的说明理由。
①Fe2O3+H2SO4= ②Ca(OH)2+Na2CO3= ③KOH+Na2CO3=
④BaCO3+Na2SO4= ⑤Cu(OH)2+MgSO4= ⑥CaCl2+H2CO3=
解析:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③不能2KOH+Na2CO3≠2NaOH+K2CO3 无气体、水、沉淀生成
④不能BaCO3+Na2SO4≠BaSO4↓+Na2CO3 BaCO3不溶于水
⑤不能Cu(OH)2+MgSO4≠CuSO4+Mg(OH)2↓Cu(OH)2不溶于水
⑥不能CaCl2+H2CO3≠CaCO3↓+2HCl因为:CaCO3+2HCl=CaCl2+H2O+CO2↑弱酸制强不能行啊
1
3类物质的化学性质
01
直接交换
酸
根据“必成盐”规则,酸的化学性质就是能和含金属的物质反应。
1、酸溶液能使紫色石蕊变红,无色酚酞不变色
2、酸+活泼金属→盐+H2 H2SO4+Mg=MgSO4+H2↑
3、酸+金属氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
4、酸+碱(金属+OH根)→盐+水 3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O
5、酸+盐(金属+酸根)→盐+酸 HCl+AgNO3=AgCl↓+HNO3
02
直接交换
碱
因为碱中含有金属离子,根据“必成盐”规则,必须和含酸根或能形成酸根(如非金属氧化物甚至金属氧化物)的物质反应生成盐。所以碱的化学性质都和酸根有关:
1、碱溶液能使紫色石紫变蓝,使无色酚酞变红。
2、碱+非金属氧化物(能形成酸根)→盐+水Ba(OH)2+C02=BaCO3↓+H20
3、碱+酸→盐+水NaOH+HCl=NaCl+H20
4、碱+盐→新碱+新盐Ba(OH)2+Na2CO3=2NaOH+BaCO3↓
03
直接交换
盐
因为盐中既有金属离子又有酸根离子,所以盐既能和含酸根又能和含金属元素的物质反应生成盐。
1.盐+金属→盐+金属 2AgNO3+Cu=2Ag+Cu(NO3)2
2.盐+酸→新盐+新酸Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
3.盐+碱→新盐+新碱FeCl3+3NaOH=3NaCl+ Fe(OH)3↓
4.盐+盐→新盐+新盐CuSO4+BaCl2=BaSO4↓+CuCl2
规律:盐1+X1→盐2+X2即反应物和生成物的类别不变
1
4类能溶于水的物质
因为盐中既有金属离子又有酸根离子,所以盐既能和含酸根又能和含金属元素的物质反应生成盐。
溶解性口诀:钾钠铵硝 (K、Na、NH4、NO3) 全都溶,硫钡(硫酸钡BaSO4想象三国时的刘备)氯化银(AgCl)不行,碱中还有Ba[Ba(OH)2]可溶。(碳酸盐和磷酸盐除钾钠铵外都不溶了)
即:要记住4种溶的,再记住3个特殊的物质:AgCl↓、BaSO4↓、Ba(OH)2可溶就行了。
还可以看出:三大强酸(HCl、H2SO4、HNO3)的盐较易溶;碳酸盐、磷酸盐和碱大多数不溶。
扩展:酸溶性多数不溶于水的物质可溶于酸。如碱和碳酸盐的沉淀都能溶于硝酸、盐酸等。
例如:Cu(OH)2+2HCl=CuCl2+2H2O CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
但AgCl和BaSO4不仅不溶于水也不溶于酸。
因为AgCl+HNO3≠HCl+AgNO3 BaSO4+2HNO3≠Ba(NO3)2+H2SO4
(无气体、水或沉淀生成,不符合复分解反应的条件)。
例如:⑴下列物质中不溶于水的有____________既不溶于水也不溶于酸的有______。
①NH4HCO3②KCl③Na2CO3④Mg(NO3)2⑤AgCl⑥BaSO4⑦BaCO3⑧Ag2CO3⑨Ba(OH)2⑩Cu(OH)2
⑵下列各组物质中,都能溶于水的是()
A.CO2 CaO Na20 Fe2O3 B.CuCl2 BaSO4 Mg(OH)2
C.KOH AgCl CuCO3 D.Ba(OH)2 NH4Cl K2CO3
解答:⑴5、6、7、8、10 5、6 ⑵ D
1
单质、氧化物、酸、碱、盐五类物质的相互关系
如图(连线为相互间反应,箭头为转变)你能否看出各种线型所表示的反应类型?粗线为化合反应,粗虚线为分解反应,细线为复分解反应,细虚线为置换反应。
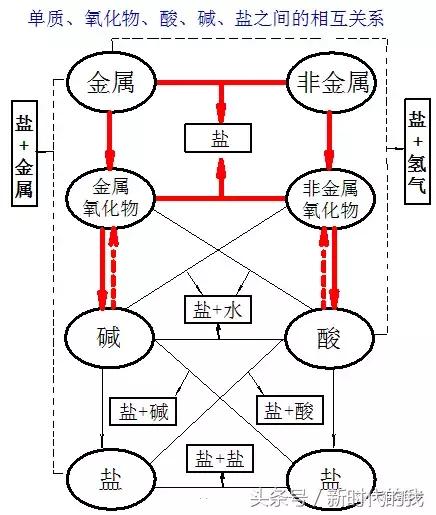
01
直接交换
相互转化和相互反应
纵行:表示了各类物质之间相互转化的关系
如:金属→金属氧化物→碱→盐
Na→Na2O→NaOH→NaCl
说明:一般的,金属活动性顺序中Mg前的金属氧化物才能与水反应生成可溶性碱,镁后的碱才能分解成相应的氧化物。如:Cu(OH)2ΔCuO+H2O
横行相连反应有:1、金属+非金属→盐
2Na+Cl2点燃2NaCl
2、金属氧化物+非金属氧化物→盐
CaO+SiO2高温CaSiO3
3、酸+碱→盐+水 NaOH+HNO3=NaNO3+H2O
4、盐+盐→盐+盐 CuSO4+BaCl2=BaSO4↓+CuCl2
斜方相连反应有:1、金属氧化物+酸→盐+水 CaO+H2SO4 =CaSO4+H2O
2、非金属氧化物+碱→盐+水 3、盐+酸→盐+酸 4、盐+碱→盐+碱
两边相连反应:1、金属1+盐1→金属2+盐2 2、金属+酸→盐+氢气
02
直接交换
各类物质的性质
如碱,碱和右上、正右、右下的物质相连就是碱的性质,其他也是如此
03
直接交换
各类物质的制取
如:盐的制备从反应生成的盐,我们可以看出盐的制备有:
(1)金属1+盐1→金属2+盐2 (2)金属+酸→盐+氢气(3)金属+非金属→盐
(4)金属氧化物+非金属氧化物→盐(5)金属氧化物+酸→盐+水
(6)非金属氧化物+碱→盐+水(7)酸+碱→盐+水(8)酸1+盐1→酸2+盐2
(9)碱1+盐1→碱2+盐2(10)盐1+盐2→盐3+盐4
共10种,被称为十大成盐规律。
如CuSO4的制取原理有:
①H2SO4+CuO=CuSO4+2H2O ②H2SO4+Cu(OH)2=CuSO4+2H2O
③H2SO4+Cu2(OH)2CO3=CuSO4+2H2O+CO2↑
④Ag2SO4+CuCl2=CuSO4+2AgCl↓ ⑤Cu+Ag2SO4=CuSO4+2Ag
⑥SO3+CuO=CuSO4⑦SO3+Cu(OH)2=CuSO4+H2O
类似的我们还可以推出酸、碱、氧化物等的制取。
从以上论述可以看出:酸碱盐的学习要善于发现规律,掌握规律。
“12345”上山打老虎,学好“12345”化学没有拦路虎。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论