中考九年级化学第1-9章知识点整理
第一章 基本概念
1、 在古代,我国化学工艺已有相当的成就,如青铜器的制造、铁和钢的冶炼与应用、火药的发明、瓷器的烧制。
2、使用煤气灶的注意点:调节气门和风门使火焰呈蓝色,一旦煤气泄漏,严禁明火,应立即关阀门,再打开门窗通风。
3、用铁锅烧菜比较好的理由:增加食物中铁元素的含量,防治缺铁性贫血。
4、水污染的途径
⑴工业上:工业上“三废”的任意排放(废水、废气、废渣)
⑵农业上:农药、化肥的不合理使用 ⑶生活上:生活污物的任意排放
5、解决淡水危机的化学方法:⑴海水淡化 ⑵污水处理
6、如何除去铁丝表面的锈: ⑴打磨 ⑵酸洗
如右图所示,锥形瓶中有饱和食盐水和细铁丝,一会儿后观察到的现象
有_________________、__________________
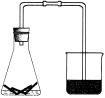
___________________________________。
8、白色污染 (1)“白色污染”不一定 是白色的;它是由废弃塑料制品 带来的污染.
(2)防治“白色污染”的方法有哪些?
a.减少使用、反复使用塑料制品 、 c.寻找替代品
b.研制可自行分解的新型塑料 、 d.回收再利用
9、发射卫星、宇宙飞船的火箭靠 高能燃料 提供动力;计算机的芯片是用半导体硅晶片材料制成的;光信息的长距离输送使用的光导纤维是用石英砂 材料制成的;航天飞机的防热瓦是用高强度陶瓷 材料制成的;制造航天航空器使用钛合金 材料,它也是21世纪最有发展前途的金属;纳米材料 是21世纪的“材料之星”;脱氧核糖核酸结构的发现 ,打开了分子生物学的大门。
10、设计实验证明金刚石中含有碳元素:___________________________
11、加热碳酸氢铵固体
(1)反应化学方程式:
(2)现象: 1、白色固体逐渐消失 2、试管壁上有水珠
3、产生有刺激性气味的气体 4、产生能使澄清石灰水变浑浊的气体
(3)将生成气体依次通过无水硫酸铜、湿润的红色石蕊试纸、澄清石灰水,现象分别是:
_________ _____ 、____________、_______________
(4) 保存碳酸氢铵的方法密闭、低温
12、加热铜绿(铜绿是绿色固体)
⑴现象:①固体由绿色逐渐变为黑色②试管壁上出现水珠③产生一种能使澄清石灰水变浑浊的气体
⑵化学方程式:
13、镁带燃烧
⑴观察现象:①发出耀眼的白光②生成一种白色固体
③产生大量的白烟④放热
⑵化学方程式:
14、氯化氢和氨气混合时发生的现象是:产生__________,反应方程式___________
煤油燃烧产生____烟,碘化钾溶液中加入硝酸银溶液后产生_____________现象(p12)
15、将铜丝放在空气中加热,方程式为_____________现象是:铜丝表面出现了__ _色固体
16、物理变化和化学变化的主要区别是:是否生成___________。
(1)化学变化中发生物理变化,物理变化中发生化学变化
(2)有发光、发热现象的变化是化学变化,如:白炽灯通电发光放热;
(3)有气体产生的变化是化学变化,如:水变成水蒸气
(4)化学变化中常伴随着能量的或,但伴随着能量变化的为化学变化。
(5)石墨转化为金刚石是_______变化(填物理或化学) ,石灰石制水泥是_______变化。
17、下列性质中属于化学性质的是___________________
①还原性 ②酸性 ③导电性 ④活性炭的吸附性 ⑤氢氧化钠易潮解 ⑥浓硫酸具有脱水性 ⑦腐蚀性 ⑧CO的毒性 ⑨浓硫酸具有吸水性 ⑩石蕊遇酸性溶液会变红
实验部分
(一) 常用仪器:
A、不能受热的仪器:量筒、集气瓶、漏斗、滴瓶、表面皿、广口瓶、细口瓶等
B、能直接受热的仪器:试管、蒸发皿、、燃烧匙
C、可间接受热的仪器:烧杯、烧瓶、锥形瓶
D、给液体加热可使用: 试管、烧杯、烧瓶、蒸发皿
E、给固体加热可使用: 试管、蒸发皿、、燃烧匙
1、试管: 常用做 ①少量试剂的反应容器 ②也可用做收集少量气体的容器
③或用于装置成小型气体的发生器
2、烧杯: 主要用于 ①溶解固体物质、配制溶液,以及溶液的稀释、浓缩
②也可用做较大量的物质间的反应
3、蒸发皿:通常用于溶液的浓缩或蒸干,加热时盛液量不超过容积的2/3
4、滴管:使用时,胶头在上,滴管必须垂直悬空于容器口的上方,用过后应立即洗涤干净,滴瓶上的专用滴管不能随便清洗。
5、量筒:常用和量取一定量体积的液体, 读数时,视线应与凹液面的最低处保持水平
6、托盘天平: 是一种称量仪器,一般精确到0.1克 。称量物放在左盘 ,砝码按
由大到小 的顺序放在右盘,取用砝码要用 镊子 ,被称物体不能直接放在托盘上,要在两边先放上等质量的纸 ,易潮解的药品或有腐蚀性的药品(如氢氧化钠)必须放在玻璃器皿 中称量。
7、广口瓶: 常用于盛放 固体试剂 ; 细口瓶: 用于盛放液体试剂 ,棕色瓶用于盛放需要避光保存 的物质。
8、长颈漏斗:用于向反应容器内注入液体,若用来制取气体,则长颈漏斗的下端管口要插入液面以下,形成液封。
9、酒精灯:①使用前先检查灯芯,绝对禁止向燃着的酒精灯里添加酒精,
②也不可用燃着的酒精灯去点燃另一酒精灯(以免失火),
③酒精灯的外焰温度最高, 应在外焰部分加热先预热后集中加热,
④要防止灯芯与热的玻璃器皿接触(以防玻璃器皿受损)
⑤实验结束时,应用灯帽盖灭(以免灯内酒精挥发而使灯芯留有过多的水分,不仅浪费酒精而且不易点燃),决不能用嘴吹灭(否则可能引起灯内酒精燃烧,发生危险)
⑥万一酒精在桌上燃烧,应立即用湿抹布扑盖
10、玻璃棒:用做搅拌(加速溶解)、引流、转移药品、pH的测定等
(二)基本操作
1、药品的取用:“三不准”。①不准用手接触药品 ②不准用口尝药品的味道
③不准把鼻孔凑到容器口去闻药品的气味
注意:已经取出或用剩后的药品一般不能在放回原试剂瓶,应放入指定的容器 。白磷、钠块可 放回原瓶
(1)固体药品的取用:不说明用量,只需盖满试管底部 。
取用块状固体用镊子 。
具体操作:先把容器横放,把药品放入容器口,再把容器慢慢的竖立起来。
取用粉末状或小颗粒状 的药品时要用药匙或纸槽
具体操作:先将试管横放,把盛药品的药匙或纸槽小心地送入试管底部,再使试管直立。
(2)液体药品的取用:不说明用量,一般取1~2毫升
具体操作:把瓶塞倒放在桌上,标签向着手心,试管倾斜,使瓶口紧挨着试管口,缓缓倒入,倾倒完毕,盖上瓶塞,标签向外放回原处。
2、物质的加热:先均匀受热,后集中药品加热。
(1)给试管中的液体加热 : 试管一般与桌面成 45°角,先预热 后集中试管底部加热,加热时切不可对着任何人,盛液量不超过容积的 1/3 。
(2)给试管里的固体加热:试管口应略向下倾斜 (防止产生的水倒流到试管底,使试管破裂)
给试管里的固体加热,试管破裂的原因:
①试管外壁有水 ②加热时试管的底部触及酒精灯的灯芯 ③试管口向上倾斜
④没有先预热后集中试管底部加热 ⑤烧得很热试管立即用冷水冲洗
3、溶液的配制
(1)物质的溶解
加速固体物质溶解的方法有搅拌(烧杯中)或振荡(试管中)、加热、将固体研细
(2)一定溶质质量分数的溶液的配制
①用固体物质的配制过程: 计算、称量、配制。
用到的仪器:托盘天平、药匙、量筒、滴管、烧杯、玻璃棒。
②用液体物质的配制过程:计算、量取、配制
用到的仪器:量筒、滴管、烧杯、玻璃棒。
4、过滤:是分离不溶性固体与液体的一种方法(如粗盐提纯;氯化钾和二氧化锰的分离)
用到的仪器:铁架台、烧杯、漏斗、玻璃棒。
过滤:操作要点:一贴、二低 、三靠
“一贴”指滤纸紧贴漏斗内壁
“二低”指 ①滤纸边缘低于漏斗边缘 ②液面低于滤纸边缘
“三靠”指 ①烧杯紧靠玻璃棒中部 ②玻璃棒轻靠三层滤纸处 ③漏斗末端紧靠烧杯内壁
过滤时速度太慢的原因是;
过滤后滤液仍浑浊的原因有;;
5、蒸发与结晶
A、蒸发是浓缩或蒸干溶液得到固体的操作;
仪器用蒸发皿、玻璃棒、酒精灯、铁架台
注意点:①在蒸发过程中要不断搅拌,作用是
②当出现大量固体时就停止加热
③使用蒸发皿应用坩埚钳夹持,后放在石棉网上
B、结晶是分离几种可溶性的固体物质
①若物质的溶解度受温度变化的影响不大,则可采用蒸发结晶的方法;
②若物质的溶解度受温度变化的影响较大的,则用降温结晶法。
6、仪器的装配: 装配时,一般按从下到上,从左到右的顺序进行。
(拆洗洗仪器时:一般按从右到左,从上到下的顺序进行)
7、检查装置的气密性: 先将导管浸入水中,后用手掌紧捂器壁,若管口有气泡冒出,当手离开后导管内形成一段水柱,且长时间不下落,证明装置气密性好。
8、玻璃仪器的洗涤清洗干净的标准是:仪器内壁上的水既不聚成水滴,也不成股流下,均匀
的附着一层水膜。
(1)如仪器上附有不溶性的碳酸盐等,可加入稀盐酸洗涤,再用水冲洗。
(2)如仪器内附有油污等可用热的纯碱溶液 洗涤,也可用洗衣粉或去污粉刷洗。
9、使用浓酸、浓碱等强腐蚀性的药品时,必须特别小心,防止皮肤或衣物等被腐蚀。
(1)如不慎将稍多量的酸(或碱液)泼在实验台上,应立即用适量的 溶液(或 )中和,然后用水冲洗,用抹布擦干。如只是少量酸或碱溶液滴到实验台上,用湿抹布擦净,再用 冲洗抹布
(2)如果不慎酸沾到皮肤或衣物上,要立即用较多的水冲洗(如果是浓硫酸,必须迅速用
擦洗后用较多冲洗),再用3%--5% 溶液和清水冲洗。若碱溶液沾到皮肤上,要用较多的 冲洗,再涂上 溶液。实验中要特别注童保护眼睛,万一眼晴里溅进了稀酸或稀碱溶液,要立即用水冲洗 切不要用手揉眼睛),必要时请医生治疗.如果溅进了浓酸或浓碱溶液,应立即送医院诊治.



第三章 基本概念
1.一切物质是由微粒构成的,一切物质是由元素组成。
(1)微粒的基本性质
①微粒是很微小的。
②微粒是在 不断运动 的。
微粒的运动快慢与 温度 有关, 温度 越高,微粒运动速度 越快 。
③微粒之间有 空隙 。
注:a. 气体 较易被压缩,而 固体和液体 不易被压缩。
b.一般情况下,微粒之间的空隙随着温度的升高而 增大,随着温度的降低而减小 。
c. 温度改变,仅是微粒之间的空隙改变,而微粒本身的大小、质量和体积不变。
(2)同种物质的分子,化学性质相同 ,不同种物质的分子, 化学性质不同 。
例:水和双氧水虽然组成元素相同,由于分子构成不同,所以化学性质不同。
注:物质发生物理变化时,分子没有 发生改变 ,因而没有生成新的物质;
物质发生化学变化时,分子 发生改变 ,生成了新的分子,新分子构成了新物质。
2.构成物质的微粒有 分子、原子、离子 。
如:NaCl由钠离子(Na+)和氯离子(Cl-)构成;铜由铜原子构成;
氧气由氧分子构成, 水由水分子构成。
(1)分子是由原子构成的。(注:①分子不一定比原子大;②分子中不含分子。)
a. 原子能构成分子,原子也能直接构成物质
注:稀有气体、金属、金刚石、硅等由原子直接构成。
b. 原子是化学反应中最小的微粒
c. 原子的构成
质子:带正电(一个质子带1个单位正电荷)
中子:不带电
核外电子(带负电:一个电子带1个单位负电荷)
注:原子由 原子核 和 核外电子 构成;或由 质子、中子、电子构成,
但普通氢原子核内无中子。
d. 原子呈电中性原因是 原子核与核外电子所带的电量大小相等,电性相反 。
e. 原子核的体积虽然很小但原子的质量几乎全部集中 原子核 上。
f.原子中:原子序数=质子数=核电荷数=电子数≠中子数
相对原子质量 = 质子数 + 中子数
相对原子质量 =
g 分子和原子的最本质的区别:在化学变化中,分子可以再分,而原子不能再分。
(2)离子:
原子中:核电荷数=质子数=核外电子数,如氧原子中质子数为8,电子数为8_。
阳离子中:核电荷数 = 质子数 > 核外电子数,如铝离子中质子数为13,电子数为10。
阴离子中:核电荷数 = 质子数 < 核外电子数,如氯离子中质子数为17,电子数为18。
3.元素 :
(1)元素是具有相同的 质子数(即核电荷数相同)同一类原子的总称。
(2)元素的种类决定于原子的 质子数或(核电荷数)。
元素的化学性质决定于原子的 最外层电子数。
元素的相对原子质量决定于 原子的质子数与中子数之和 。
(3)自然界中元素的存在:
a.地壳中元素含量(从大到小)排列 氧、硅、铝、铁、钙;
注:地壳中含量最多的金属元素是:铝(Al),含量最多的非金属元素是:氧
b.人体中元素含量(从大到小)排列 氧、碳、氢、氮、钙
人体中含量最多的金属元素是钙
c.太阳上最丰富的元素是氢(H),其次是氦(He);
d. 海水中含量最多的物质 水(H2O) ,海水中原子个数最多的是 (氢原子H)
海水中含量最多的非金属元素 氧(O ),海水中含量最多的金属元素 钠(Na) ;
e. 空气中含量最多的元素是 (N ) ,空气中含量最多的物质是_氮气(N 2);
f. 通常状况下呈液态的金属是_汞(Hg)。
(4)元素与人体健康:
缺_ 钙_元素:骨质疏松畸形,得佝偻病;缺 铁 元素:易得缺铁性贫血症;
缺 锌 元素:会使儿童发育停滞,智力低下,得侏儒症;
缺_ 碘 元素:会得甲状腺疾病;
注:元素并不是吸入越多越好。
如: 钙 吸收过多,容易引起白内障、动脉硬化等,
微量的_硒(Se)元素可以防癌,过量的 硒(Se) 则是致癌的因素之一。
(5)人体中微量元素:铁Fe、铜Cu、锰Mn、锌Zn、钴Co、碘I、硒Se等。
4.物质的简单分类
混合物 酸
物质 单质 碱
纯净物 无机化合物 盐
化合物 有机化合物 氧化物
(1)混合物不一定由不同种分子构成,但由不同种分子构成的物质一定是混合物。
如:铁、铜混合物由不同种原子构成
(2)纯净物不一定由同种分子构成,但由同种分子构成的物质一定是纯净物。
纯净物都有固定的组成,都能用一种化学式表示;混合物没有固定的组成。
(3)单质: 由同种元素组成的纯净物称为单质
注意:单质只含一种元素,
但含一种元素的物质可能是单质,也可能是混合物,绝对不是化合物)
(4)化合物:由不同种(或有两种或两种以上)元素组成的纯净物称为化合物
不同种元素组成的物质,可能是化合物也可能是混合物,但不可能是单质
(5)有机化合物:含碳化合物,简称有机物。CH4是最简单的有机物
(6)无机化合物:不含碳化合物,简称无机物。一氧化碳、二氧化碳(碳的氧化物)、碳酸和碳酸盐(含CO32-)性质与无机物相似,归于无机物研究。
(7)氧化物:由 两种 元素组成,其中有一种元素是 氧元素 的化合物。如:CO、Fe2O3注:水是相对分子质量最小的氧化物。
(8)酸:离解产生的阳离子全部是氢离子的化合物。如:H2SO4、HNO3
(9)碱:离解产生的阴离子全部是氢氧根离子的化合物。如:NaOH、Ca(OH) 2
(10)盐:离解产生金属离子和酸根离子的化合物。NaCl、CaSO 4
注:酸碱盐氧化物中都一定含有非金属元素,但不一定含有金属元素;酸碱中一定含有
5.熟记常见元素的化合价
常见元素化合价口诀:(根据各班口诀自行默写)













③在初中化学所学知识范围内,KNO3、NaNO3、BaSO4、AgCl一般不发生复分解反应。
28、中和反应 : 酸 和 碱 作用生成 盐 和 水 的反应。
中和反应 都是放热 反应,中和反应一定是_复分解_反应;农业上,常施用 熟石灰 改良酸性土壤。人的胃液中胃酸过多,胃会疼痛;可服用“胃舒平”或“斯达舒”(内含氢氧化铝)的药物,反应方程式 Al(OH)3+3HCl== AlCl3+3H2O。制好的松花蛋中因含有碱性物质,尝起来有涩味,在食用时最好加入厨房内 食醋 调味品,可除去涩味。被蚂蚁、蚊子等昆虫叮咬了,涂上 稀氨水 _ 或_肥皂水_可以止痛、消肿。
29、盐:(1)盐的组成:_一般有金属离子和酸根离子构成_ 如 高锰酸钾
(★盐中不一定含有金属离子 如 硝酸铵NH4NO3 、氯化铵NH4Cl等铵盐)
(2)盐的溶解性:①钾盐、钠盐、铵盐、硝酸盐都全部可溶,
②盐酸盐(氯化物)除 AgCl_不溶外,其余都可溶。
③硫酸盐中除BaSO4_不溶,_CaSO4 Ag2SO4微溶外,其余都可溶。
④碳酸盐中除_K2CO3、Na2CO3、(NH4)2CO3_溶于水,__MgCO3_微溶外,其余不溶。
⑤磷酸盐中K3PO4、Na3PO4、(NH4)3PO4溶于水,其余不溶。
30、盐的化学性质
(1)金属能与盐反应生成新盐和新金属(置换反应)
如:湿法炼铜:Fe + CuSO4 === Cu + FeSO4
现象:铁丝表面覆盖一层红色物质,溶液由蓝色变为浅绿色。
如:Cu + 2AgNO3 === Cu(NO3)2 + 2Ag
现象:铜丝表面覆盖一层银白色的物质,,溶液由无色变为蓝色。
(2) 盐能与酸反应生成新盐和新酸_(复分解反应)
(3) _盐能与碱反应生成新碱和新盐(复分解反应)
(4) _盐能与盐反应生成新盐和新盐(复分解反应)
31、常见物质的用途:
(1)KMnO4:用于实验室制氧气,作消毒剂。
(2)H2O2:用于实验室制氧气,作消毒剂。
(3)CuSO4(白色粉末):检验水的存在(遇水白色变蓝色),
配农药波尔多液、杀菌消毒,炼铜。
(4)氢氧化钙:(溶解度随温度升高而减小;微溶) ①建筑材料 ②工业制烧碱
③制农药波尔多液 ④杀害虫,鸡蛋保鲜 ⑤改良酸性土壤等
(5)CaO:作建筑材料,作食品干燥剂,制熟石灰。
(6)石灰石、大理石:主要成分CaCO3,作建筑材料,制水泥,生石灰。
(纯净的CaCO3可补钙剂、牙膏填充剂)
(7)硫酸钡:悬浊液在医学上作“钡餐”。用于X射线检查肠胃疾病
(8)盐酸:是胃酸的主要成分,用于金属表面除锈,帮助消化。稀硫酸用于除锈,也可用于蓄电池。
(9)NaOH:造纸、制肥皂。
(10)Na2CO3:生产玻璃、发酵粉、热的纯碱溶液可作洗涤剂用于去油污。
(11)NaHCO3:发酵粉、可用于治疗胃酸过多症。
(12)食盐:是一种调味品和防腐剂,也是重要化工原料:做融雪剂、配生理盐水(0.9%的食盐水)
(13)明矾:作净水剂,吸附悬浮的杂质使其沉降。
(14)木炭、活性炭:有吸附性(用于除去异味、有色色素、有毒气体)等。
(15)水:最常见的溶剂,可配制溶液,可溶解、洗涤物质,可灌溉农田等。
(16)酒精:绿色可再生能源,医用酒精(体积分数70—75%的酒精溶液)用于消毒。
(17)硝酸钾:常见复合肥料,溶解度随温度升高而增大(提纯常用降温结晶法)。
(18)硝酸铵(NH4NO3):氮肥;溶于水吸热;氮元素化合价为-3和+5。
(19)盐酸、硝酸、氨水:有挥发性。
32、我国化工专家侯德榜在纯碱制造方面作出了重大贡献。





 加载中,请稍侯......
加载中,请稍侯......
精彩评论