初中化学方程式归纳总结
1、澄清石灰水中通入二氧化碳气体(复分解反应)
Ca(OH)2 + CO2=== CaCO3↓ + H2O现象:石灰水由澄清变浑浊。
相关知识点:(1)检验二氧化碳气体的存在;(2)石灰浆粉刷墙壁。
2、镁带在空气中燃烧(化合反应)
2Mg+O2点燃2MgO
现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁化学性质很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3、水通电分解(分解反应)
2H2O通电2H2↑+ O2↑
现象:通电后,电极上出现气泡,气体体积比约为1:2
相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电。
4、生石灰和水反应(化合反应)
CaO + H2O === Ca(OH)2
现象:白色块状固体变为白色未溶解粉末。
相关知识点:(1) 为生石灰制备石灰浆的反应,最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙;(4)反应发出大量的热。








一、物质的学名、俗名及化学式
1、单质: 金刚石、石墨、炭黑:C 汞、水银:Hg 硫、硫磺:S
2、氧化物: 固体二氧化碳、干冰:CO2氧化钙、生石灰:CaO 氧化铁、铁锈的主要成份:Fe2O3
3、酸: 盐酸:HCl的水溶液 碳酸(汽水):H2CO3
4、碱: 氢氧化钠、苛性钠、火碱、烧碱:NaOH 氢氧化钙、熟石灰、消石灰:Ca(OH)2
氨水:NH3·H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)
5、盐: 碳酸钠、苏打、纯碱(不是碱,是盐,但其溶液显碱性):Na2CO3
碳酸氢钠、小苏打:NaHCO3大理石,石灰石的主要成份是CaCO3
食盐的主要成分是NaCl亚硝酸钠、工业用盐:NaNO2 (有毒)
硫酸铵:(铵盐是一类不含金属离子的盐)(NH4)2SO4 碳酸钾、草木灰的主要成份:K2CO3
6、有机物: 甲烷、沼气、天然气的主要成份:CH4乙醇、酒精:C2H5OH
葡萄糖:C6H12O6 甲醛:有毒
醋酸CH3COOH(具有酸的通性)
二、常见物质的颜色和状态
1、白色固体:CaO、MgO、P2O5、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、CaCO3等
2、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色固体
3、红色固体:单质Cu、红磷 化合物:Fe2O3▲硫:淡黄色固体
4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色;其余溶液一般无色。
5、常见七大沉淀( 即不溶于水的盐和碱 ):
①盐:白色↓:CaCO3、BaCO3(溶于酸,有气泡); AgCl、BaSO4(也不溶于稀HNO3) 等
②碱:蓝色↓:Cu(OH)2;红褐色↓:Fe(OH)3; 白色↓:Mg(OH)2(溶于酸)。
6、(1)具有刺激性气体的气体: SO2、HCl、 NH3(皆为无色)
(2)无色无味的气体:O2、H2、N2、CO2、CO(剧毒)
(3)可燃性气体:H2、CH4、CO
三、物质的某些性质和用途(用于判断物质)
1、单质:
①N2:焊接金属作保护气、填充灯泡和食品包装袋(都是因为氮气的化学性质不活泼)、液氮作医疗冷冻麻醉剂
②O2:供给呼吸(潜水、医疗急救),支持燃烧(炼钢、气焊)。 氧气作助燃剂,不是燃料。
③稀有气体:制多种用途的电光源如航标灯,霓虹灯(利用物理性质通电时能发出不同颜色的光)
④H2:最轻的气体、清洁能源 用途:冶炼金属 充气球一般用更安全的氦气
⑤碳:金刚石:制钻头; 石墨:电极材料、高温润滑剂; 炭黑:制油墨、填橡胶
木炭和活性炭(吸附性):除异味、除色素,防毒面具中一般用活性炭;
⑥P:红磷燃烧测定空气中氧气的体积分数、发令枪、烟幕弹 白磷燃烧探究质量守恒定律、探究燃烧条件
⑦S:制火药、火柴、鞭炮 ⑧Mg:作照明弹
2、氧化物:①H2O:生命必须物质、常温下呈液态的氧化物、最常用的溶剂、相对分子质量最小的氧化物。
②CO:煤气的主要成份、作燃料、冶炼金属、有毒
③CO2:引起温室效应气体:灭火、汽水、气体肥料干冰:人工降雨、致冷剂、舞台云雾剂
④SO2:引起酸雨,煤、硫磺燃烧、放鞭炮时产生的气体
⑤NO2:引起酸雨和光化学烟雾、汽车排放的尾气中含有。
⑥P2O5:白磷或红磷燃烧产生的大量白烟(固体小颗粒)
⑦CaO:食品干燥剂、建筑材料,和水反应放出大量热
3、酸:①碳酸:制碳酸饮料(汽水、雪碧等)
②盐酸:金属除锈、除水垢、胃液中助消化
③硫酸:金属除锈、蓄电池中的填充液、浓硫酸作干燥剂
4、碱:①氨水(NH3·H2O):作氮肥
②NaOH:易吸水潮解,溶于水放出大量热,用于制肥皂、石油炼制、造纸,去除油污如做炉具清洁剂,固体可作干燥剂、溶液用于吸收酸性气体如CO2、 SO2
③Ca(OH)2:建筑材料、改良酸性土壤,中和酸性废水,澄清溶液用于检验CO2
5、盐:①NaCl:调味、防腐剂、选种、腌渍食品、生理盐水(0.9%)、融雪剂、维持人体酸碱性平衡
②CaCO3:重要的建筑材料、工业生产石灰、补钙剂、实验室制CO2、除CaCl2中的盐酸
Na2CO3:洗涤剂、做馒头去酸性物质并使其松软、用于玻璃造纸和纺织业、泡沫灭火器的填充物
NaHCO3:发酵粉、治疗胃酸过多、干粉灭火器的填充物、
皮肤上沾了浓硫酸,用大量水冲洗后涂3%~5% NaHCO3的溶液
③CuSO4:用于湿法炼铜、农业杀菌剂、波尔多液、检验水
6、有机物:①CH4:最简单的有机物、沼气、天然气、可燃冰,气体化石燃料、大量燃烧会产生温室效应
②C2H5OH:酒精、有特殊香味、可再生能源、作饮料、医疗消毒杀菌、实验室用得最多的燃料
③CH3COOH:调味、厨房中可用其区别食盐和纯碱、除水垢、制无壳鸡蛋
7、有毒的物质:
气体:CO、SO2、NO2、 甲醛:有毒; 甲醇(CH3OH),致失明、死亡
固体:NaNO2 、黄曲霉素、CuSO4(可作杀菌剂 ,与熟石灰混合配成粘稠状的波尔多液)
8、常见化肥 氮肥:NH4Cl、NH4HCO3、(NH4)2SO4 、NaNO3、NH3·H2O、CO(NH2)2使叶浓绿
钾肥:KCl、K2SO4、K2CO3(草木灰的主要成分), 使茎粗壮
磷肥:磷酸二氢钙、过磷酸钙、磷矿粉, 使根发达
复合肥:KNO3、NH4H2PO4
9、三大白色建筑材料: CaO、Ca(OH)2、CaCO3
10、治疗胃酸过多 Mg(OH)2、Al(OH)3(中和)、NaHCO3、CaCO3
11、三大干燥剂:浓硫酸(不能干燥碱性气体如NH3) 固体NaOH、生石灰(不能干燥酸性气体如CO2、SO2)12、三大还原剂:固体单质C、 气体单质H2、 氧化物CO
五、化学之最
1、地壳中含量最多的非金属元素是氧、金属元素是铝。2、人体中含量最多的元素是氧、金属元素是钙。
3、海水中含量最多的元素是氧、金属元素是钠。 4、组成化合物种类最多的元素是碳。
5、最简单的有机物是甲烷CH4。 6、相对分子质量最小的单质是氢气、氧化物是水。
7、相同条件下密度最小的气体是氢气。 8、导电性最强的金属是银、导热性最好的金属是银。
9、熔点最低的金属是汞、熔点最高的金属是钨。10、硬度最大的金属是铬。
11、天然存在最硬的物质是金刚石。 12、人类最早使用的金属是铜
13、日常生活中应用最广泛的金属是铁。 14、最早利用天然气的是中国,最早运用湿法炼铜的是中国
15.含氮量最高的常见化肥是尿素; 16.最理想的气体燃料是氢气;
17、在金属活动顺序中:等质量的活泼金属与足量的盐酸反应产生氢气最多的是铝。
18、我国古代“四大发明”中与化学知识联系最密切的两大发明是造纸、制火药。
七、能量变化:
1、溶于水放出大量热的物质:生石灰(CaO)、固体NaOH、浓硫酸
2、溶于水吸收大量热的物质:硝酸铵(NH4NO3)
3、放热反应:氧化反应、中和反应、金属与酸的反应、CaO与水反应
4、吸热反应:大多数分解反应、氧化物的还原反应(冶炼金属)、高温下C分别与CO2、水蒸气反应
八、原子结构知识中的几种决定关系:
1、质子数(核电荷数)决定元素的种类 2、质子数+中子数=原子的相对原子质量
3、有关原子的等量关系:质子数=核电荷数=核外电子数=原子序数
3、原子最外层的电子数决定:元素的类别(最外层电子数≥4:非金属元素;最外层电子数<4:金属元素;最外层电子数=8:稀有气体元素,氦为2)
化学性质(最外层电子数≥4:易得到电子;最外层电子数<4:易失去电子;最外层电子数=8:化学性质稳定)
主要化合价、形成离子时所带电荷数(得电子:带负电形成阴离子;失电子:带正电形成阳离子)
4、金属活动性决定金属与酸、金属与可溶盐能否反应
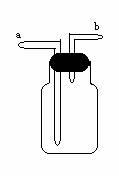
、关于洗气瓶:
1、检验并吸收少量CO2:瓶内盛石灰水,气体从a进
除去并吸收大量CO2:瓶内盛氢氧化钠溶液,气体从a进
2、除去CO2中的HCl:瓶内盛饱和NaHCO3溶液,气体从a进
检验HCl:瓶内盛硝酸银溶液,气体从a进
3、除去水蒸气:瓶内盛浓硫酸,气体从a进
4、用排空气法收集气体:密度比空气大:气体从a进
密度比空气小:气体从b进
用排水法收集气体:瓶内盛满水,气体从b进,a处接导管通入量筒中
5、输氧:瓶内装水,氧瓶接a(观察气泡速度、控制输氧速度)
6、贮气瓶:瓶内盛满气体,要把气体导出,应从a进水
注:气体检验及除杂和干燥:先检验再除杂后干燥
十二、重要知识提示
1、碱+盐、盐+盐反应的反应物应溶于水,生成物中一般要有沉淀(铵盐与碱反应则会生成氨气)。
4、气体吸收:
NaOH固体:吸水和酸性气体(如少量的二氧化碳,二氧化硫、氯化氢、硫化氢等)
NaOH溶液:吸酸性气体:CO2、SO2、HCl等
浓硫酸:水和碱性气体(NH3)
5、常用干燥剂及干燥范围:
(1)浓硫酸:不能干燥碱性气体。
(2)氢氧化钠固体:不能干燥酸性气体。
(3)生石灰:不能干燥酸性气体。
(4)碱石灰(NaOH和CaO的混合物):不能干燥酸性气体。
6、除杂(括号中的是杂质):
(1)CO(CO2):NaOH溶液 (2)CO2(CO):通过灼热的氧化铜
(3)O2(H2O):浓硫酸或氢氧化钠固体或生石灰 (4)CO2(H2O):浓硫酸
(5)CO2(HCl):饱和NaHCO3溶液 (6)CO2(O2):灼热的铜网
(7)NaOH(Na2CO3):Ca(OH)2溶液 (8)NaCl(Na2CO3):稀盐酸或CaCl2溶液
(9)NaOH [Ca(OH)2]:Na2CO3溶液 (10)FeSO4(CuSO4):铁粉
(11)CaCl2(HCl):CaCO3 (12)CuO(C):在空气中灼烧
(13)C(CuO):稀硫酸或稀盐酸 (14)Cu(Fe):稀硫酸或稀盐酸
(15)KCl(MnO2):溶解、过滤
7、用浓盐酸与大理石反应制取二氧化碳时,生成气体通入澄清石灰水,不变浑浊,原因是气体中混有的氯化氢先与石灰水反应。
8、用浓盐酸与大理石反应制取二氧化碳时,生成气体通入紫色石蕊溶液,石蕊溶液变红的原因可能是CO2与水反应生成了H2CO3,也可能是气体中混有氯化氢溶于水生成了盐酸。
9、相对分子最小的氧化物,同时既能与金属氧化物反应又能与非金属氧化物反应的是水
10、相同质量的锌、镁、铁、铝加入等质量、等浓度的盐酸(或硫酸)中,
(1)若酸完全反应,则产生氢气一样多
(2)若酸完全反应,消耗金属最多的是锌,最少的是铝(消耗金属质量与 相对原子质量/化合价 成正比)
(3)若金属完全反应。则产生氢气质量:Al> Mg> Fe> Zn(氢气质量与 化合价/相对原子质量 成正比)
(4)反应速度最快的是镁,最慢的是铁(可据此判断金属活动性)
11、化学肥料:上中下,氮钾磷。叶黄缺氮,易倒伏缺钾,植株矮小、谷穗不饱满缺磷。
1、H2[HCl] 通入氢氧化钠溶液:HCl+NaOH=NaCl+ H2O
2、CO2[HCl]通入饱和的碳酸氢钠溶液:HCl+NaHCO3= NaCl+H2O+ CO2↑
3、CO[CO2] 通入足量的石灰水 或足量的氢氧化钠溶液: CO2+2NaOH==Na2CO3+H2O
4、CO2[CO] 通过灼热的氧化铜 CO+CuO △ Cu+CO2
5、气体的干燥H2、 CO2、 CO[H2O] 可用浓硫酸、无水氯化钙、氢氧化钠固体、碱石灰(氧化钙和氢氧化钠固体混合物)、无水硫酸铜等除去
如:H2(水蒸气):通过浓硫酸/通过氢氧化钠固体 ;CO2(水蒸气):通过浓硫酸
6、CuO(C):在空气中(在氧气流中)灼烧混合物 C + O2 点燃 CO2
7、Cu(Fe) :加入足量的稀硫酸 Fe + H2SO4 = FeSO4 + H2↑
8、Cu(CuO):加入足量的稀硫酸 CuO + H2SO4 ==== CuSO4 + H2O
9、FeSO4(CuSO4): 加 入足量的铁粉 Fe + CuSO4 === FeSO4 + Cu
10、NaCl(Na2CO3):加 入足量的盐酸 Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
11、NaCl(Na2SO4):加入足量的氯化钡溶液
Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
12、NaCl(NaOH):加入足量的盐酸 HCl + NaOH ==== NaCl +H2O
13、NaOH(Na2CO3):加入足量的氢氧化钙溶液Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
14、NaCl(CuSO4):加入足量的氢氧化钡溶液
Ba(OH)2 + CuSO4 ==== Cu(OH)2↓ + BaSO4↓
15、NaNO3(NaCl):加入足量的硝酸银溶液 NaCl + AgNO3 ==== AgCl↓ + NaNO3
16、NaCl(KNO3):蒸发溶剂 17、KNO3(NaCl):冷却热饱和溶液。
18、CaO[CaCO3]只能煅烧(不可加盐酸) CaCO3高温CaO+CO2↑
注意:检验CaO是否含CaCO3加盐酸 :CaCO3+2HCl==CaCl2+H2O+CO2↑
(CO32-的检验:先加盐酸,然后将产生的气体通入澄清石灰水。)
 加载中,请稍侯......
加载中,请稍侯......
精彩评论