高三化学二轮复习题型专练含解析(文件编号:21041004)
目录:
高三化学二轮复习题型专练含解析:阿伏伽德罗常数
高三化学二轮复习题型专练含解析:电化学
高三化学二轮复习题型专练含解析:化工流程
高三化学二轮复习题型专练含解析:化学实验
高三化学二轮复习题型专练含解析:化学与生活
高三化学二轮复习题型专练含解析:基本理论
高三化学二轮复习题型专练含解析:离子反应
高三化学二轮复习题型专练含解析:盐类水解
高三化学二轮复习题型专练含解析:有机推断
高三化学二轮复习题型专练含解析:有机物性质
高三化学二轮复习题型专练含解析:原子结构和周期律
高三化学二轮复习题型专练含解析:综合性化学实验
关注微信公众号:cc518xxzl 可免费领取本资料word完整版!
简介:
高三化学二轮复习题型专练含解析:阿伏加德罗常数
![]() 题型专练02 阿伏加德罗常数
题型专练02 阿伏加德罗常数
1. 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24LH2O和H2O2混合物中所含氢原子数为0.2NA |
B.0.1 mol·L-1的CH3COONa溶液中含有CH3COO-数小于0.1NA |
C.23gC2H6O含有的共价键数一定为4NA |
D.化学反应中生成1molO2,转移的电子数一定为4NA |
【答案】C

2. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA
B.标况下,22.4LNO与11.2LO2混合后气体的分子数小于NA
C.标准状况下,22.4L己烷中共价键数目为19NA
D.常温常压下,将0.1molFe投入足量的浓硝酸中,转移的电子数为0.3 NA
【答案】B
【解析】A、25℃,pH=11![]() 的Na2CO3溶液中存在离子积常数,c(H+)=10-11mol/L;c(H+)×c(oH-) =10-14 ;由水电离出的[H+]=[OH-]=10-14/ 10-11==10-3mol/L;溶液体积不知,由水电离出的氢离子的数目无法计算,故A错误;B、标准状况下,22
的Na2CO3溶液中存在离子积常数,c(H+)=10-11mol/L;c(H+)×c(oH-) =10-14 ;由水电离出的[H+]=[OH-]=10-14/ 10-11==10-3mol/L;溶液体积不知,由水电离出的氢离子的数目无法计算,故A错误;B、标准状况下,22![]() .4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2⇌N2O4,则气体的分子总数小于NA个,故B正确.C、标况下,己烷为液态,故C错误;D、铁与足量浓硝酸发生钝化现象,所以铁不能完全反应,故D错误。
.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol,由2NO+O2═2NO2,2NO2⇌N2O4,则气体的分子总数小于NA个,故B正确.C、标况下,己烷为液态,故C错误;D、铁与足量浓硝酸发生钝化现象,所以铁不能完全反应,故D错误。
3. 设N A为阿伏加德罗常数的值,下列叙述正确的是
A.60g二氧化硅晶体中含有NA个SiO2分子 |
B.光照条件下,16 gCH4 与71g Cl2反应生成的CH3Cl 分子数为NA |
C.1mol Li 在空气中充分燃烧生成Li2O,转移电子数为2NA |
D.标准状况下,22.4 LNO与NH3的混合气体中所含氮原子数为NA |
【答案】D
【详解】A.二氧化硅是原子晶体,不是分子,A错误;B.CH4 与 Cl2发生反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、氯化氢五种物质,因此16gCH4 与71gCl2反应生成的CH3Cl分子数小于NA,B错误;
C.1molLi完全反应转移电子数为NA,C错误;D.22.4LNO与NH3的混合气体为1mol,含有含氮原子数为NA ,D正确。
4.洁厕灵和84消毒液混合使用会发生反应:NaClO+2HCl=NaCl+Cl2↑+H2O,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是
A.每生成1mol氯气,转移的电子数为2NA
B. 1molNaCl含有的电子数为28NA
C. 1L0.2mol/LNaClO溶液中含有的次氯酸根离子数为0.2NA
D.标准状况下,将22.4LHCl溶解在0.5L水中,形成2mol/L的盐酸
【答案】B

5. NA为阿伏加德罗常数的值,下列说法正确的是( )。
A: 标准状况下,2.24L乙烷与2.24L苯含C-H键数均为0.6NA
B:16.8gFe与足量的水蒸气加热充分反应,转移电子数为0.8 NA
C:25℃ 时,1LpH=7的CH3COONH4溶液中含NH4+数一定为10-7 NA
D:0.2molCO2与0.1molC在密闭容器中充分反应生成CO分子数为0.2NA
【答案】B
【解析】A项,标准状况下,苯是液体,2.24L苯无法计算微粒数,故A项错误;B项,16.8gFe的物质的量为0.3mol,与足量的水蒸气加热充分反应,化学方程式为3Fe+4H2O=Fe3O4+4H2,转移电子数为0.8mol即为0.8 NA ,故B项正确;C项,25℃ 时,1LpH=7的CH3COONH4溶液中:c(CH3COO-)=c(NH4+),浓度未知,无法计算NH4+的个数,故C项错误;D项,在高温下密闭容器中CO2与C生成CO是可逆反应 ,不能进行彻底,故D项错误。
6. 设NA表示阿伏加德罗常数值。下列说法正确的是( )
A.标准状况下,11.2L的甲醇所含的氢原子数等于2NA
B. 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和和溶液中Ba2+数目为1×10-5NA
C.常温常压下,Na2O2与H2O反应生成1molO2时,转移电子数是2 NA
D. 1L1mol·L-1AlCl3溶液中含有的Al3+数目为NA
【答案】C
【解析】标准状况下甲醇是液体,故A错误;Ksp(BaSO4)=1×10-10,则BaSO4饱和和溶液中c(Ba2+)=
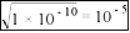
7. 设NA为阿伏加德罗常数的数值。下列说法正确的是( )。
A:5.6gFe与过量稀硝酸反应,转移的电子数为0.3NA
B: 标准状况下,2.24L苯含C-H键的数目为0.6 NA
C:K35ClO3 与浓HCl反应制得7.1g氯气,则生成的Cl2分子数为NA
D:6.4gCu 与40mL10mol/L浓硝酸充分反应,生成的NO2分子数为0.2NA
【答案】A

8. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )。
A:0.1molNa2O2和Na2O的混合物中含有的离子总数大于0.3NA
B:10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C:0.2molN2和0.6molH2混合充分反应后,转移的电子数目为1.2 NA
D:0.5molHCHO 和C2H2O3的混合物完全燃烧,消耗的O2分子数目为0.5 NA
【答案】D
【解析】A项,Na2O2 和Na2O均是由两个阳离子和一个阴离子构成的离子化合物,所以0.1molNa2O2 和Na2O的混合物中含有的离子总物质的量为0.3mol,个数为0.3NA,故A项错误;B项,乙醇溶液中除乙醇外,水也含氢原子,10g质量分数为46%的乙醇中,乙醇的质量为4.6g,物质的量为0.1mol,故乙醇含有0.6mol氢原子,水的质量为10-4.6-5.4g,物质的量为0.3mol,故水含有0.6mol氢原子,则此溶液中含有氢原子的物质的量为1.2mol,个数为1.2 NA ,故B项错误;C项, 因N2和H2合成NH3的反应是可逆反应,0.2molN2和0.6molH2不能完全转化为NH3,转移的电子数目小于1.2 ![]() NA,故C项错误 。D项,因1molHCHO 和1mol C2H2O3完全燃烧消耗O2的物质的量均为1mol,所以0.5molHCHO和C2H2O3的混合物完全燃烧,消耗的O2的物质的量为0.5mol ,分子数目为0.5NA ,故D项正确。
NA,故C项错误 。D项,因1molHCHO 和1mol C2H2O3完全燃烧消耗O2的物质的量均为1mol,所以0.5molHCHO和C2H2O3的混合物完全燃烧,消耗的O2的物质的量为0.5mol ,分子数目为0.5NA ,故D项正确。
9. 设NA为阿伏加德罗常数值,下列有关叙述正确的是( )。
A: 常温常压下,30g乙烷气体中所含有的共价键数目为6NA
B: 标准状况下,0.4Gd2中所含中子的数目为0.2 NA
C: 常温下,1LpH=12的氨水溶液中含有NH4+数目为0.01NA
D: 标准状况下,盛有11.2LNO2的密闭容器中氮原子数为0.5 NA
【答案】B

10. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,2.24L SO3中含有0.1NA个SO3 分子
B.向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C.常温下,将2.7g铝片投入足量的浓硫酸中,转移电子的数目为0.3NA
D.常温常压下,7.0g由丁烯与丙烯组成的混合气体中含有的氢原子数目为NA
【答案】D
【解析】A、标准状况下SO3为固体,所以不能计算其物质的量,故A错误;B、由于NO2能转化为N2O4,所以容器内的分子数小于NA,故B错误;C、常温下铝在浓硫酸中钝化,所以不能发生反应,故C错误;D、丁烯与丙烯的最简式都CH2,所以7.0g由丁烯与丙烯组成的混合气体中,n(CH2)=0.5mol,所以含有的氢原子数目为NA,即D正确。
11. 设NA为阿伏加德罗常数的数值。下列有关叙述错误的是 ( )
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
【答案】C
【解析】A、N2和CO摩尔质量都是28g·mol-1,且两者都属于双原子分子,28g此混合物含有原子物质的量为2mol,故A说法正确;B、过氧化钠的电子式为
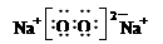
12. 用![]() NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温下,1L0.1 mol•L-1CH3COONa溶液中CH3COO-离子数目为0.1NA |
B.标准状况下,11.2LHF含有0.5 NAHF分子 |
C.将含0.1mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目小于0.1 NA |
D.含19.6gH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
【答案】C

13. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.所含共价键数均为0.4 NA 的白磷P4和甲烷的物质的量相等
B.10浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C.2gH2分别与足量的Cl2和N2充分反应后转移的电子数均为2NA
D.1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
【答案】C
【解析】A.白磷分子中含有6个P-P键,甲烷分子中含有4个C-H键,0.1mol的白磷共价键数0.6mol,0.1mol甲烷中所含的共价键数均为0.4 NA ,故A错误; B.10g质量分数为46%的乙醇水溶液中含有乙醇4.6g,含有0.1mol乙醇,1.2mol乙醇中含有0.6molH原子;溶液中水的质量为10-4.6=5.4g,水的物质的量为0.3mol,含有0.6mol氢原子,所以该乙醇的水溶液中含有1.2molH原子,含有的氢原子总数为1.2 NA ,所以B选项是正确的;
C.2gH2分别与足量的Cl2充分反应后转移的电子数均为2 NA ,和N2反应是可逆反应,反应后转移的电子数小于2 NA ,故C错误; D.铁离子具有氧化性能氧化碘离子生成碘单质,2Fe3++2I-=2Fe2++I2,溶液中所含I-的数目小于3NA ,故D错误。
14. NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A.10ml0.1mol/L的CH3COOH溶液中氧原子数为0.002NA
B.0.2mol/L的NaCl溶液中,Na+数为0.2NA
C.0.1mol的Na2O2与足量的CO2反应,转移电子数为0.1NA
D.在标准状况下4.48L的CH2Cl2其分子数为0.2NA
【答案】C
【解析】
水中含有氧原子,所以10ml0.1mol/L的CH3COOH溶液中氧原子数大于0.002NA,故A错误;没有溶液体积,不能计算Na+数,故B错误;0.1mol的Na2O2与足量的CO2反应,转移电子数为0.1NA,故C正确;在标准状况下CH2Cl2是液体,故D错误。
15. 设阿伏加德罗常数的值为NA,下![]() 列说法中正确的是( )
列说法中正确的是( )
A.常温常压下,7.8g苯中含有单键的数目为0.9 NA,
B.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA,
C.标准状况下,2.24LCHCl3含有的分子数为0.1 NA,
D.1molCnH2n+2中共价键数为(3n+2) ![]() NA
NA
【答案】B

16. 通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.1molBaCl2晶体中所含微粒总数为0.1NA
B.25℃时,pH=1的HC1溶液中含有H+的数目为0.1NA
C.l7gH2![]() O2中含
O2中含![]() 有非极性键数目为0.5NA
有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
【答案】C
【解析】A.由钡离子和氯离子构成,故0.1mol BaCl2晶体中所含微粒总数为0.3NA,选项A错误;B.没有给定体积,无法计算H+的数目,选项B错误;C.H2O2的结构式为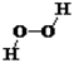 ,l7gH2O2为0.5mol,含有非极性键数目为0.5NA,选项C正确;D.根据反应SO2+H2O2+BaCl2=BaSO4↓+2HCl,生成2.33 gBaSO4沉淀(0.01mol)时,转移电子数目为0.02NA,选项D错误。
,l7gH2O2为0.5mol,含有非极性键数目为0.5NA,选项C正确;D.根据反应SO2+H2O2+BaCl2=BaSO4↓+2HCl,生成2.33 gBaSO4沉淀(0.01mol)时,转移电子数目为0.02NA,选项D错误。
17. 下列叙述正确的是( )。
A:24g镁与27g铝中,含有相同的质子数
B: 同等质量的氧气和臭氧中,电子数相同
C:1mol 重水(D2O)与1mol水中,中子数比为2;1
D:1mol乙烷和1mol乙烯中,化学键数相同
【答案】B

18. 用NA代表阿伏加德罗常数的值.下列说法正确的是(
A.标准状况下,1.12L戊烷所含共价键数目为0.8NA
B.1L0.1mol/L(NH4)2SO4 溶液中含N原子数为0.2NA
C.2.2g D218O与T2O的混合物中所含质子数、中子数均为NA
D.25mL16mol/L浓硫酸与13g锌共热,转移的电子数小于0.4 NA
【答案】B
【解析】A、戊烷标准状况下不是气体,不能使用气体摩尔体积,故A错误; B、n(NH4)2SO4=0.1mol ,则n(N)=0.1×2=0.2mol,故溶液中含N原子数为0.2NA ,所以B选项是正确的; C、1molD218O含12mol中子数,10mol质子数,1molT2O含12mol中子数,10mol质子数,则1molD218O 与T2O所含质子数和中子数不等,故均为NA 错误,故C错误; D、锌不管与浓硫酸还是稀硫酸反应后都变为+2价,则1mol锌反应转移2mol电子,则13 g锌相当于0.2mol锌,故转移0.4mol电子,故转移的电子数等于0.4NA ,故D错误。
19. NA表示阿伏加德罗常数的数值,下列说法正确的是
A.在标准状况下.11.2L丙烷含有的极性键数目为5NA |
B.7g锂在空气中完全燃烧时转移的电子数为NA |
C.1mol葡萄 |
D.常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA |
【![]() 答案】B
答案】B

20. NA表示阿伏伽德罗常数的值,下列叙述错误![]() 的是
的是
A. 2gD2A16O中含有的质子数、中子数、电子数均为NA
B. 80g CuO和Cu2S的混合物含有铜原子数一定为NA
C. 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA
D. 500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA
【答案】C
【解析】A、1个D216O含有的质子数、中子数、电子数均为10,2gD216O的物质的量为:2g÷20g/mol=0.1mol,所以2gD216O中含有的质子数、中子数、电子数均为NA,正确;B、CuO的摩尔质量为80g/mol, Cu2S的摩尔质量为160/mol,含有2个Cu,所以80g CuO和Cu2S的混合物含有铜![]() 原子数一定为NA,正确;C、O2可被还原为-2价,也可能为还原为-1价,如Na与O2反应生成Na2O2,错误;D、根据物料守恒,500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA,正确。
原子数一定为NA,正确;C、O2可被还原为-2价,也可能为还原为-1价,如Na与O2反应生成Na2O2,错误;D、根据物料守恒,500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA,正确。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论