高考化学二轮复习选择题标准练含答案解析(文件编号:21040801)
目录:
高考化学二轮复习选择题标准练含答案解析(一)
高考化学二轮复习选择题标准练含答案解析(二)
高考化学二轮复习选择题标准练含答案解析(三)
高考化学二轮复习选择题标准练含答案解析(四)
高考化学二轮复习选择题标准练含答案解析(五)
高考化学二轮复习选择题标准练含答案解析(六)
高考化学二轮复习选择题标准练含答案解析(七)
高考化学二轮复习选择题标准练含答案解析(八)
高考化学二轮复习选择题标准练含答案解析(九)
高考化学二轮复习选择题标准练含答案解析(十)
高考化学二轮复习选择题标准练含答案解析(十一)
高考化学二轮复习选择题标准练含答案解析(十二)
高考化学二轮复习选择题标准练含答案解析(十三)
高考化学二轮复习选择题标准练含答案解析(十四)
关注微信公众号:cc518xxzl 可免费领取本资料word完整版!
简介:
高考化学二轮复习选择题标准练含答案解析(一)
选择题标准练(一)
(分值42分,建议用时:10~15分钟)
7.如图是硫元素在自然界中的循环示意图,下列有关说法不正确的是( )
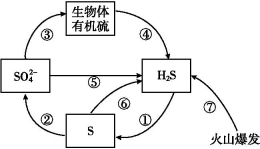
A.硫在自然界中既有游离态又有化合态
B.过程⑤宜在土壤的缺氧区实现
C.硫元素的循环过程中只有硫的还原
D.若生物体有机硫的成键方式为
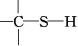
8.下列说法正确的是( )
A.苯能被酸性KMnO4溶液氧化
B.乙烯可以用作生产食品包装材料的原料
C.糖类都可以发生水解反应
D.CH4与Cl2在光照条件下反应的产物都难溶于水
9.Cl2O是一种黄棕色、具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
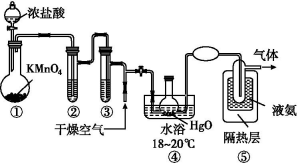
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2的沸点为-34.6 ℃;
HgO+2Cl2

A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.两份2.7 g铝分别与100 mL浓度为2 mol/L的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA
B.50 ℃时,1 L pH=1的H2SO4溶液含H+的数目为 0.1NA
C.氢氧燃料电池负极消耗1.12 L气体时,电路中转移的电子数为0.1NA
D.1 mol NaHSO4在熔融状态下电离出的阳离子数为2NA
11.下列关于有机物说法不正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.萘环(
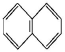
C.对甲基苯乙烯中最多有17个原子共面
D.纤维素和淀粉都是多糖,它们彻底水解后的产物相同
12.X、Y、Z、W为原子序数依次递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应)。下列判断中正确的是( )
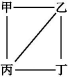
A.X是元素周期表中非金属性最强的元素
B.Z可通过电解其氯化物的方式获得
C.4种原子中,Y离子半径最小
D.W的阴离子可能促进水的电离
13.三室式电渗析法处理废液(HCl和FeCl2混合溶液)的原理如图所示,其中X、Y均为离子交换膜。在直流电场的作用下,中间室得到盐酸,阴极区可回收铁。下列说法正确的是( )
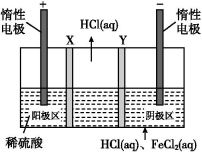
A.X、Y依次是阴离子透过膜和阳离子透过膜
B.通电后,阴极区溶液的pH不断减小
C.阳极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
D.中间室得到1 L 2 mol/L盐酸时,电路中通过1 mol电子
7.C 硫在自然界中有游离态和化合态两种存在形式,A项正确;在土壤中缺氧的条件下可实现⑤的转化,B项正确;题图循环过程中①、②均为硫的氧化,C项不正确;结合生物体有机硫中S的成键方式可知,S元素为-2价,则过程④中S元素化合价未发生变化,D项正确。
8.B 苯不能被酸性KMnO4溶液氧化,A错误;乙烯通过加聚反应生成聚乙烯,其可以用作生产食品包装材料的原料,B正确;单糖不能发生水解反应,双糖和多糖可以发生水解反应,C错误;CH4与Cl2在光照条件下反应的产物中的卤代烃难溶于水,但氯化氢易溶于水,D错误。
9.C 制取Cl2O需要干燥纯净的氯气,所以②③中盛装的试剂依次是饱和食盐水和浓硫酸,故A正确;高浓度的Cl2O易爆炸,所以通入干燥空气可以将生成的Cl2O稀释减少爆炸危险,故B正确;装置⑤是用液氨冷却反应后的混合物,此时Cl2O和过量的Cl2为液态,所以逸出的气体是空气,故C不正确;Cl2O与有机物接触会发生燃烧并爆炸,装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸,故D正确。
10.B 化合物中Al化合价为+3,所以无论与足量酸还是与足量碱反应,2.7 g即0.1 mol铝转移电子均为0.3NA,但根据关系式Al~3HCl,Al~NaOH,知盐酸不足而NaOH过量,所以转移电子数前者小于后者,故A错误;pH=1,所以c(H+)=0.1 mol/L,所以氢离子数目为0.1NA,故B 正确;氢氧燃料电池负极为H2放电,根据关系式 H2~2e-,1.12 L即标准状况下0.05 mol氢气,转移电子数为0.1NA,由于C项没说明是标准状况,故C错误;熔融状态下硫酸氢钠电离方程式为NaHSO4 Na++HS
Na++HS
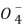
11.A BrCH2CHBrCH2Br的名称为1,2,3

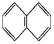
正确。
12.D Y、Z是金属元素,再结合X、Y、Z、W最高价氧化物对应水化物之间的反应可推知,Y是Na、Z是Al,则乙是NaOH、丙是Al(OH)3,而Al(OH)3属于两性氢氧化物,则甲是HNO3、丁是H2SO4或HClO4等,所以X是N、W是S、P或Cl。元素周期表中非金属性最强的元素是F,A错误;AlCl3是共价化合物,熔融状态不导电,所以工业上通过电解熔融Al2O3的方法制取Al,B错误;N、Na、Al三种原子形成的简单离子的电子层结构相同,原子序数越大,半径越小,所以离子半径:Al3+<Na+<N3-,C错误;若W为S元素,则S2-能促进水的电离,D正确。
13.C 通电后,阳极区电极反应式为2H2O-4e-![]() 4H++O2↑,产生的H+通过X离子交换膜进入中间室,考虑电荷守恒,Cl-通过Y离子交换膜进入中间室,得到盐酸,所以X是阳离子透过膜,Y是阴离子透过膜,A错误;通电后,阴极区可回收铁,则Fe2+在阴极得电子生成Fe,氢离子浓度不变,阴极区溶液的pH不变,B错误;通电后,阳极发生氧化反应,电极反应式为2H2O-4e-
4H++O2↑,产生的H+通过X离子交换膜进入中间室,考虑电荷守恒,Cl-通过Y离子交换膜进入中间室,得到盐酸,所以X是阳离子透过膜,Y是阴离子透过膜,A错误;通电后,阴极区可回收铁,则Fe2+在阴极得电子生成Fe,氢离子浓度不变,阴极区溶液的pH不变,B错误;通电后,阳极发生氧化反应,电极反应式为2H2O-4e-![]() 4H++O2↑,C正确;根据阳极电极反应可知,中间室得到1 L 2 mol/L盐酸时,电路中通过2 mol电子,D错误。
4H++O2↑,C正确;根据阳极电极反应可知,中间室得到1 L 2 mol/L盐酸时,电路中通过2 mol电子,D错误。
 加载中,请稍侯......
加载中,请稍侯......
精彩评论