物质的分离与除杂 专项复习训练
一、填空题
1、请回答下列与物质提纯有关的问题。
(1)下列两个方案都可以除去铜粉中的少量氧化铜:①用稀盐酸除去氧化铜;②用CO还原氧化铜。从环境保护和操作简便等方面考虑,较好的方案是 (填“①”或“②”)。
(2)要除去K2SO4溶液中的少量KOH,不能选用稀盐酸,原因是会生成 (填具体物质的名称或化学式),而引入新的杂质。
(3)要使NaCl溶液中的少量Na2SO4转化为沉淀而除去,可选用适量的 。
(4)要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸,再通过足量的氢氧化钠溶液后,氢气中仍含有的杂质是 。
2、除去下列物质中混有的杂质,将所用试剂或方法填在横线上(括号内的物质为杂质)。
(1)CaO(CaCO3) 。
(2)MnO2(C) 。
(3)Cu(Zn) 。
(4)NaCl溶液(Na2CO3) 。
(5)Na2CO3(NaHCO3) 。
(6)KCl溶液(BaCl2) 。
(7)FeSO4溶液(CuSO4) 。
(8)NaCl溶液(CaCl2) 。
(9)NaOH溶液(Na2SO4) 。
(10)KNO3溶液(K2CO3) 。
(11)KNO3溶液(NaCl) 。
(12)CO(CO2) 。
(13)CO2(CO) 。
(14)CO2(HCl) 。
(15)CO2(O2) 。
(16)H2(HCl) 。
3、为了回收硝酸亚铁和硝酸银的混合溶液中的银,设计了如图所示的实验方案。
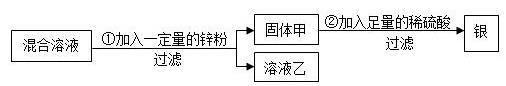
(1)若溶液乙为无色溶液,则固体甲一定有的物质是 ,可能有的物质是 ,步骤②中肯定发生的反应的化学方程式为 。
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是 或
(填物质的名称或化学式)。
4、某河道两旁有甲、乙两厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 。乙厂的废水中含有另外三种离子,分别为 、 、 。一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的离子转化为沉淀,经过滤后的废水主要含 ,可用来浇灌农田。
二、选择题
5、下列各组物质中,能用过滤法分离的一组物质是 ( )
A. 汽油和水 B. 食盐和白糖
C. 木炭和氧化铜 D. 氯酸钾和二氧化锰
6、要除去铜粉中的少量铁粉,可加入下列试剂中的 ( )
A. 水 B. 稀盐酸
C. 硫酸亚铁 D. 硝酸银溶液
7、除去氢氧化钠溶液中混有的氢氧化钙,可选用的试剂是 ( )
A. 碳酸钠溶液 B. 盐酸
C. 硫酸铜溶液 D. 氯化钡溶液
8、粗盐中难溶性杂质的去除过程中,涉及称量、溶解、过滤、蒸发等过程。下列说法不正确的是 ( )
A. 称量时,粗盐放在天平左盘的称量纸上 B. 粗盐溶解时,要用玻璃棒不断搅拌
C. 蒸发时,在恰好蒸干时停止加热 D. 过滤时,漏斗下端管尖紧靠烧杯内壁
9、除去下列物质中的少量杂质(括号内为杂质),所用试剂正确的是 ( )
A. CaO[Ca(OH)2]:H2O B. NH3(水蒸气):浓硫酸
C. MnO2(KCl):H2O D. NaOH溶液(Na2CO3):CaCl2
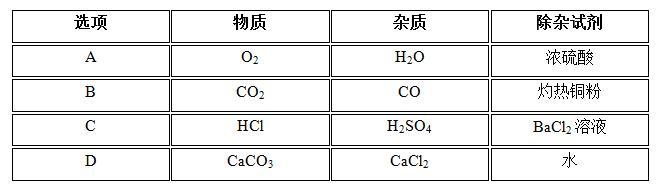
10、下列除杂所选试剂错误的是 ( )
11、下列各组离子在溶液中能大量共存的是 ( )
A. K+、SO42-、N O3- B. NH4+、OH-、Cl-
C. Cu2+、Na+、OH- D. Ca2+、K+、CO32-
12、除去NaCl溶液中的Na2SO4和CaCl2杂质的操作有:①加入过量的BaCl2溶液;②过滤;③加入适量盐酸;④蒸发结晶;⑤加入过量Na2CO3溶液。正确的操作顺序是 ( )
A. ①⑤②③④ B. ③①⑤②④
C. ①③⑤④② D. ⑤③②①④
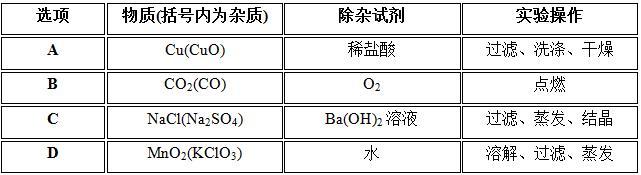
13、除去下列物质中的少量杂质,所选试剂及操作方法都正确的是 ( )
14、对某pH=2的溶液成分进行分析、检测,下列结果合理的是 ( )
A. KNO3、K2CO3、NaNO3、CaCl2 B. KCl、NaHCO3、K2SO4、NaCl
C. NaCl、ZnSO4、KNO3、KOH D. HCl、MgCl2、Na2SO4、NaCl
15、把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是 ( )
A. H2O、NaOH、HCl B. H2O、KOH、HCl
C. H2O、NaOH、H2SO4 D. H2O、KOH、H2SO4
三、实验探究题
16、现只有稀盐酸、浓硫酸和氢氧化钠溶液,用如图1所示装置对CO和CO2的混合气体进行分离和干燥。
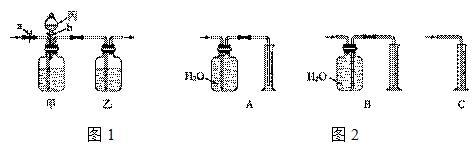
(1)甲中应盛 ;乙中应盛 。
(2)首先打开止水夹a,可分离出 ,反应的化学方程式为 。
(3)再关闭止水夹a,从丙处加入稀盐酸,又可分离出 ,反应的化学方程式为 ,此时所得的CO2气体可能含有 。
(4)有一位同学想测定分离出来的CO的体积,请帮助该同学从图2所示A、B、C三个装置中选择一个合理的量气装置: 。
(5)如果只有浓硫酸和氢氧化钠溶液,能否分离得到纯净的CO2气体? (填“能”或“不能”)。为什么? 。
17、物质除杂是化学实验中经常遇到的问题。
方法探究 为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种实验方案。
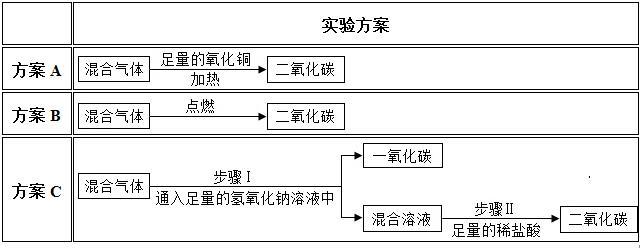
上述方案中有两种是合理的,写出合理方案中任意一个反应的化学方程式: 。
方法提炼 上述两种合理方案体现了物质除杂的不同思路。
思路一:将杂质直接转化为所需物质。
思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
方法运用 运用思路一:为除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的 溶液,过滤、蒸发,即得氯化镁固体。
运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。
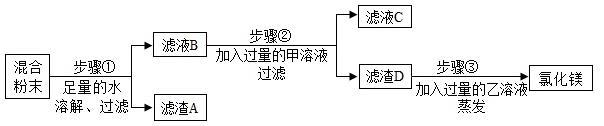
步骤①中反应的化学方程式是 ,滤液B中一定含有的溶质是 ;步骤②中反应的化学方程式是 ,滤液C中一定含有的阴离子是 ;步骤③中乙溶液是 (填化学式)溶液。
四、综合题
18、从盐湖中提取的某种矿物主要含有氯化钾,还有少量硫酸镁、氯化钙及不溶性杂质SiO2,从该矿物中提取氯化钾的流程如图。
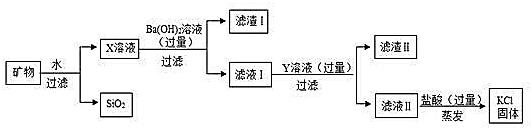
回答下列问题。
(1)滤渣Ⅰ的主要成分是 。
(2)Y溶液中溶质的化学式为 。
(3)向滤液Ⅱ中加入过量盐酸的目的是 。
(4)蒸发溶液得到氯化钾固体的过程中,要用玻璃棒不断搅拌,目的是 。
参考答案
一、填空题
1、. (1)① (2)氯化钾(或KCl) (3)氯化钡溶液 (4)水蒸气
2、 (1)高温煅烧 (2)在空气中灼烧
(3)加足量稀硫酸,过滤、洗涤、干燥
(4)加适量稀盐酸
(5)加热
(6)加适量硫酸钾溶液,过滤
(7)加足量铁粉,过滤
(8)加适量的碳酸钠溶液,过滤
(9)加适量的氢氧化钡溶液,过滤
(10)加适量的稀硝酸
(11)降温结晶
(12)通过灼热的碳层(合理即可)
(13)通过灼热的氧化铜
(14)通过饱和的碳酸氢钠溶液和浓硫酸
(15)通过灼热的铜网
(16)通过氢氧化钠溶液和浓硫酸
3、. (1)银、铁 锌 H2SO4+FeFeSO4+H2↑
(2)硝酸锌、硝酸亚铁[或Zn(NO3)2、Fe(NO3)2]
硝酸锌、硝酸亚铁、硝酸银[或Zn(NO3)2、Fe(NO3)2、AgNO3]
4、OH- Cl- K+ Ag+ Fe3+ NO3- KNO3
二、选择题
5、D
6、B
7、A
8、C
9、C
10、B
11、A
12、A
13、A
14、D
15、A
三、实验,探究题
16、(1)氢氧化钠溶液 浓硫酸
(2)CO CO2+2NaOHNa2CO3+H2O
(3)CO2 Na2CO3+2HCl2NaCl+CO2↑+H2O HCl
(4)B
(5)能 CO2与NaOH反应,转化为Na2CO3,浓硫酸稀释为稀硫酸,可与Na2CO3反应生成CO2
17、 方法探究CO+CuOCu+CO2(或2NaOH+CO2Na2CO3+H2O或Na2CO3+2HCl2NaCl+CO2↑+H2O,任写一个即可)
方法运用MgSO4(或硫酸镁) BaCl2+K2SO42KCl+BaSO4↓ MgCl2、KCl、NaCl(或氯化镁、氯化钾、氯化钠)
MgCl2+2NaOH2NaCl+Mg(OH)2↓(合理即可) OH-、Cl- HCl
四、综合题
18、(1)Mg(OH)2、BaSO4
(2)K2CO3
(3)除去溶液中过量的KOH和K2CO3
(4)防止加热过程中液体局部温度过高,造成液滴飞溅
 加载中,请稍侯......
加载中,请稍侯......
精彩评论