对高中生物物质鉴定实验的复习一般都是这样展开的(以淀粉、还原性糖、蛋白质、脂肪、DNA的鉴定实验为例):
一、通过实验的结果分析
上述鉴定实验的基本方法是运用某些化学试剂与生物组织中有关化合物的特定颜色反应来判断化合物的存在,这是这些实验的原理,同时也是考查的重点,在高考中多以选择题的方式出现。
二、各反应的过程可以简单表达
1. 淀粉+革兰氏碘液
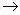
蓝色或蓝紫色。
2. 可溶性糖的还原性糖+斐林试剂
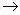
砖红色沉淀

4.
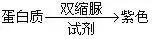
5.

三、实验材料的选择
实验材料的选择是实验成功的关键,使用好的材料能得到较好的实验效果。
上述实验中选材需要注意的地方如下:
1. 可溶性还原性糖的鉴定:还原糖的含量和生物组织中有无色素是影响实验结果及其观察的最重要的因素。
因此要选用可溶性还原性糖含量高和白色或近于白色的植物组织,其中以苹果、梨最好,也可用白色的甘蓝叶、白萝卜替代。经实验比较,颜色反应的明显程度依次为:苹果、梨、白色甘蓝叶、白萝卜。
2. 脂肪的鉴定:所用材料一要脂肪含量高,二要较大,这样才能做徒手切片,花生种子符合该实验的要求。将花生种子浸泡3h~4h,使其变软,有利于切成薄片;浸泡时间不宜过长,否则组织太软,切下的薄片不易成形。
3. 蛋白质的鉴定:一般选用浸泡1d~2d的富含蛋白质的大豆种子(便于研磨)或用鸡蛋清。
4. DNA的鉴定:鸡血细胞液。
四、实验方法与步骤
(以教材叙述为准,此处略)
五、疑难聚集
1. 在做还原性糖与蛋白质鉴定的实验时,在鉴定前,为什么要留出一部分样液?
答:虽然是验证性实验,但也要注意对照。在鉴定可溶性还原性糖和蛋白质时留出一部分样液,可以和鉴定后的样液的颜色变化作对照,增强说服力。
2. 蛋白质为什么要稀释?
答:制备蛋白质稀释液,主要是为了防止蛋白质与双缩脲试剂反应后粘在试管壁上,使反应不彻底,也不易刷洗试管。
3. 斐林试剂与双缩脲试剂都由NaOH和CuSO4组成,两者有何不同?
答:①溶液浓度不同:斐林试剂由质量浓度为0.1g/mL的NaOH溶液和质量浓度为0.05g/mL的CuSO4溶液配制而成,双缩脲试剂的成分是质量浓度的0.1g/mL的NaOH溶液与质量浓度为0.01g/mL的CuSO4溶液。
②使用原理不同:斐林试剂实质是新配制的一定浓度的Cu(OH)2溶液,在加热条件下,与加入的可溶性还原性糖能够生成砖红色的Cu2O沉淀。双缩脲试剂实质是在碱性环境下的
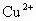
与双缩脲(H2NOC—NH—CONH2)作用,形成的紫色或紫红色的络合物。
③使用方法不同:斐林试剂在使用时,先把NaOH溶液和CuSO4溶液混合,而后立即使用。双缩脲试剂使用时,先加NaOH溶液,振荡均匀再加CuSO4溶液。
4. 反应过程中,出现的颜色变化及原因分别是什么?
答:斐林试剂鉴定还原性糖的实验:
开始时加入的刚配制的Cu(OH)2部分被还原成砖红色的Cu2O沉淀,二者混合呈现棕色,随着反应的继续进行,Cu(OH)2被全部还原成Cu2O,故出现砖红色沉淀。颜色变化:浅蓝色→棕色→砖红色(沉淀)。
双缩脲试剂鉴定蛋白质实验:
加入双缩脲试剂A,溶液无色,加入双缩脲试剂B,因有Cu(OH)2生成,故呈现浅蓝色,振荡均匀后由于反应的进行出现紫色的络合物。颜色变化:无色→浅蓝色→紫色。
5. 斐林试剂为何要现配现用?用斐林试剂鉴定时为何不能先加入NaOH再加入CuSO4,而必须混合后再加入?
答:因斐林试剂很不稳定,容易生成蓝色的Cu(OH)2沉淀,所以应将甲液与乙液分别配制储存,使用时再临时配制。
若先加入NaOH,还原性糖中的还原性半缩醛羟基易被氧化而失去还原性,再加入CuSO4后不能生成砖红色的Cu2O沉淀,只有将其先配制成Cu(OH)2溶液才能生成砖红色沉淀。
6. 为何在鉴定还原性糖的实验中,一般不选用双子叶植物和单子叶植物的叶片?
答:在双子叶植物中,光合作用的主要产物葡萄糖形成后合成淀粉,暂时储存在叶片内,因此最好不要选用双子叶植物的叶片做实验材料。单子叶植物如韭菜并不将光合作用的初始产物转变成淀粉,因此叶片内含有大量的可溶性还原糖,但是由于叶片中叶绿素的颜色较深,对于鉴定时的颜色起掩盖作用,导致实验现象不明显,因此也不选用单子叶植物的叶片。
7. 在使用双缩脲试剂时,为什么要先加入试剂A,后加入试剂B?加入试剂A后,为什么只能加入3~4滴双缩脲试剂B,而不能加过量?
答:①先加入试剂A是为了造成碱性环境,因为在碱性环境中,蛋白质容易与Cu2+发生颜色反应。
②因为若加入过量的双缩脲试剂B,CuSO4在碱性溶液中生成大量的蓝色Cu(OH)2沉淀,会遮蔽实验中所产生的紫色,影响观察。
8. 在鉴定DNA的实验中,提取DNA时为什么要除去血液中的上清液?
答:因为上清液是血浆,不含血细胞,而沉于试管底部的鸡血细胞的细胞核中才含有DNA,所以提取鸡血细胞中的DNA时,要除去血液中的上清液。
9. 在提取DNA的步骤中先后2次加入蒸馏水,作用相同吗?为什么?
答:不同,第一次加入蒸馏水是为了使溶液浓度低于血细胞内部浓度,水分子大量渗入血细胞中,使血细胞胀破而得到DNA。第二次加入蒸馏水是为了使氯化钠的物质的量浓度达到DNA溶解度的最低点0.14mol/L,这时DNA分子就会从氯化钠溶液中析出。
10. DNA的直径约为2nm,实验中出现的丝状物的粗细是否表示一个DNA分子直径的大小?
答:实验中出现的丝状物是肉眼可以看到的,这种丝状物的直径要比DNA分子的直径2nm大许多倍,所以实验中出现的丝状物的粗细并不表示一个DNA直径的大小。
11. 实验中有3次过滤,作用及使用的纱布层数有何区别?
答:第一次过滤是为了过滤鸡血细胞液得到含DNA的滤液,使用的纱布为1~2层。
第二次过滤是为了从低浓度的氯化钠溶液中析出附在纱布上的含DNA的黏稠物,所用纱布为多层。
第三次过滤的目的是得到再溶解后的DNA滤液,所以只要用两层纱布即可。
12. 实验中有6次搅拌,搅拌时应注意些什么?
答:除最后一次搅拌外,前5次搅拌均要朝着一个方向,并且在析出DNA、DNA再溶解和提取中各步搅拌都要轻缓,玻璃棒不要直插烧杯底部,防止DNA分子断裂。
13. 实验中有3次加入NaCl溶液,目的分别是什么?
答:第一次加入NaCl后必须充分晃动烧杯,使二者混合均匀,加速染色质中DNA与蛋白质的分离,使DNA充分游离并溶解在NaCl溶液中;第二次加是为了DNA再溶解,不过此时溶液中的蛋白质含量已经很少了;第三次加入的NaCl溶液浓度比前两次低得多,但还是为了溶解DNA。
14. 影响此实验效果的因素有哪些?
答:(1)提取DNA时,搅拌充分与否会影响细胞破裂程度,进而影响到提取的DNA的量。
(2)沉淀DNA时,必须用冷酒精,在15℃以下至少存放24h。
(3)用玻璃棒搅拌时,玻璃棒不要直接插入烧杯底部,搅拌要轻缓,才能获得完整的DNA分子。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论