第12题 化学反应原理综合判断
题组三 图像题专项突破
[解题指导]
1.审题
观察图像时,一定要看清楚两坐标的具体含义,明确图像中各曲线的意义,注意各曲线上出现的拐点、特殊点、起点、终点表示的含义。
2.析题
根据题中、图中信息,明确涉及哪些化学反应原理,如涉及化学反应,写出可能发生反应的化学方程式或离子方程式,并与相关数据结合起来,有效地做到数形结合。
3.解题
(1)在识图像、想原理的基础上,将图像与原理结合起来思考,找准切入点。
(2)一是任何条件下,只要溶液中c(H+)=c(OH-),一定呈中性;二是溶液中电荷一定守恒。
4.检查
最后要对试题进行认真检查核对,避免失误。
[挑战满分](限时20分钟)
1.在一定条件下,取一定量X和Y在恒容密闭容器中发生反应:aX(g)+bY(g)cM(g)+dN(g) ΔH=Q kJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列判断正确的是( )
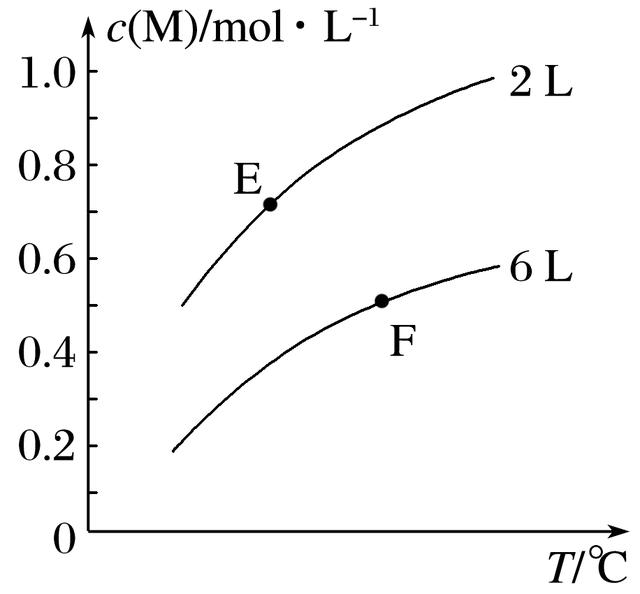
A.a+b>c+d
B.Q<0
C.E点X的转化率>F点X的转化率
D.E点的平衡常数<F点的平衡常数
2.一定条件下,密闭容器中发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g),反应中的能量变化如图所示。下列说法正确的是( )
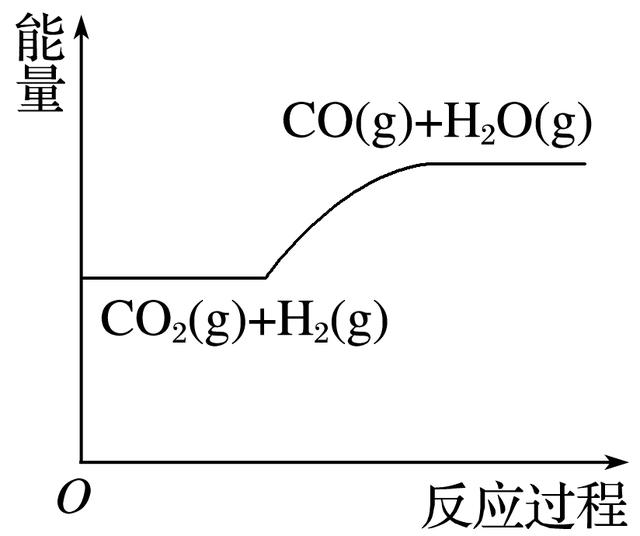
A.反应体系中加入催化剂可增大焓变
B.加压可使化学平衡正向移动
C.升温可使化学平衡正向移动
D.增大H2浓度可使达到新平衡时CO的体积分数增大
3.如图表示可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是( )
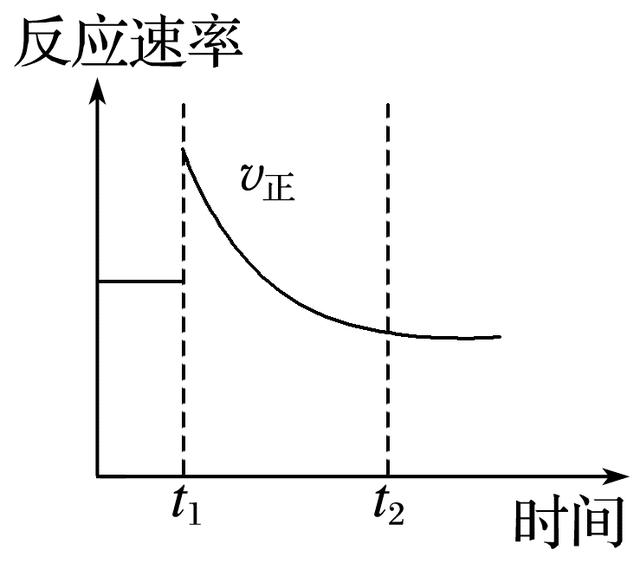
A.t1时降低了温度,平衡向正反应方向移动
B.t1时增大了压强,平衡向正反应方向移动
C.t1时增大了N2的浓度同时减小了NH3的浓度,平衡向正反应方向移动
D.t1时可能使用了催化剂
4.某温度下,向一定体积0.1 mol·L-1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )
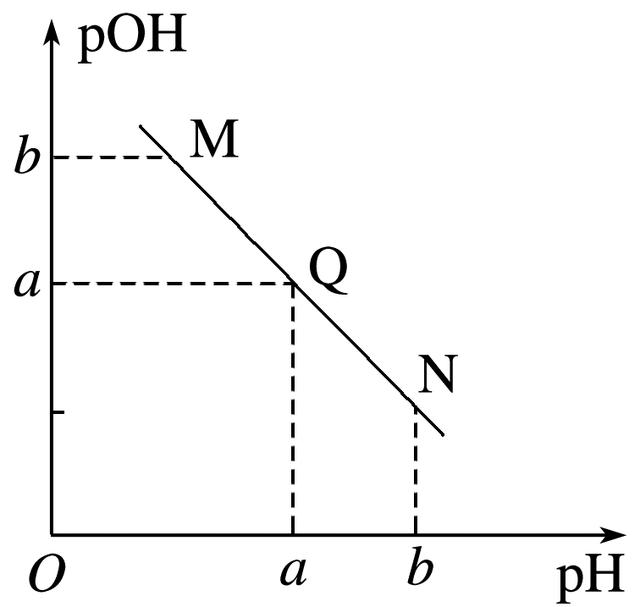
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
5.标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是( )
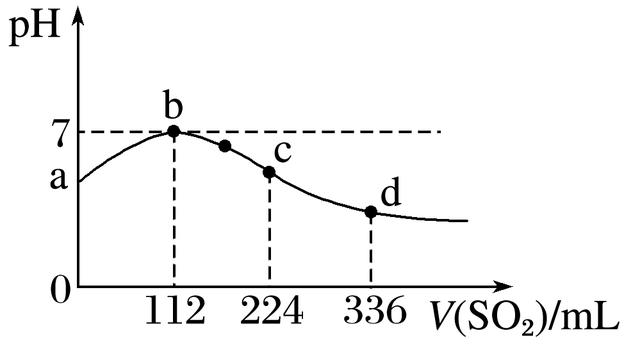
A.原H2S溶液的物质的量浓度为0.05 mol·L-1
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
6.在25 ℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中正确的是( )
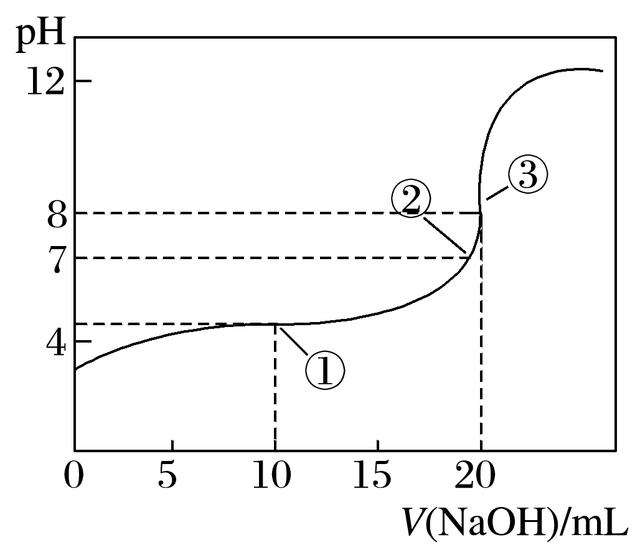
A.该中和滴定过程,最宜用石蕊作指示剂
B.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度
C.图中点②所示溶液中,c(CH3COO-)=c(Na+)
D.滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在
7.已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO(aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是( )
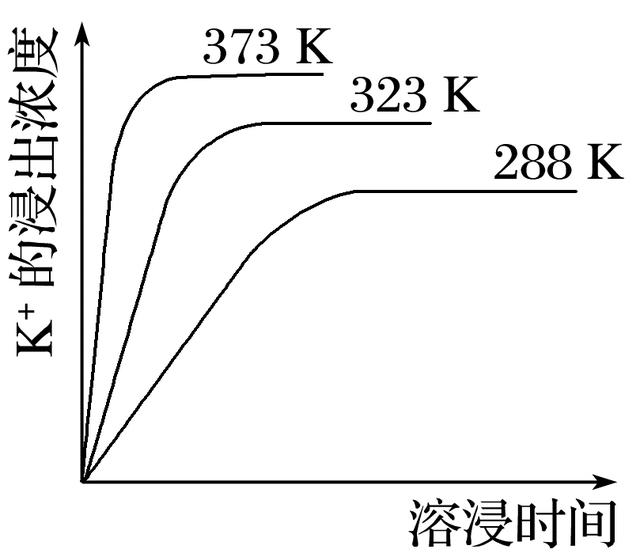
A.向该体系中加入饱和NaOH溶液,沉淀溶解平衡向右移动
B.向该体系中加入饱和碳酸钠溶液,沉淀溶解平衡向右移动
C.升高温度,反应速率增大,平衡向正反应方向移动
D.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO)
8.室温下,将10.00 mL 5.00 mol·L-1醋酸滴入100.00 mL蒸馏水中,溶液中c(H+)和温度随醋酸体积变化的曲线如图所示。下列有关说法正确的是( )
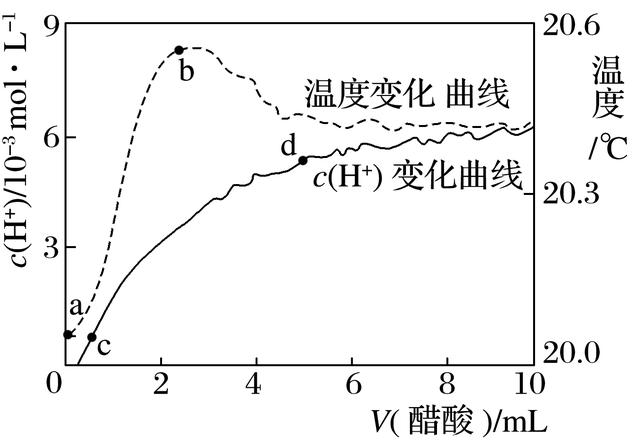
A.a~b段,醋酸的电离为放热过程
B.c~d段,c(H+)增大,醋酸电离度增加
C.c点时,加入等体积等浓度的NaOH溶液,则:
c(Na+)=c(CH3COO-)+c(CH3COOH)
D.d点时,c(H+)>c(CH3COOH)
9.已知:25 ℃时,Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液的体积的关系如图所示。当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列说法正确的是( )
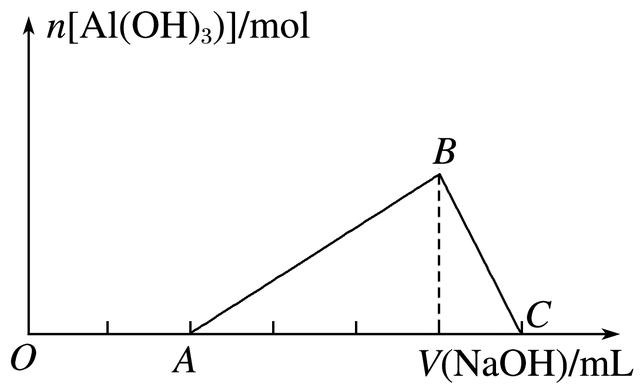
A.原混合溶液中c(Fe3+)∶c(Al3+)=1∶1
B.若Fe(NO3)3溶液中混有杂质Al(NO3)3,可以加入过量的NaOH溶液除去
C.B点两种沉淀共存,此时上层溶液中c(Al3+)∶c(Fe3+)=2.5×104
D.C点溶液中的溶质只有NaAlO2
1.答案 D
解析 容器容积不变的情况下,随着温度的升高,M的平衡浓度逐渐增大,说明平衡正向移动,正反应为吸热反应,故Q>0,B项错误;在同温度下,比较两条曲线上某两个点,比如就比较两个曲线的起点,可知当容器容积缩小到原来的三分之一时,M的平衡浓度没有增大到原来的三倍(0.6 mol·L-1),而是0.5 mol·L-1,说明平衡逆向移动了,故a+b<c+d,A项错误;由E点到F点,温度升高、压强减小,这两个改变条件均有利于平衡正向移动,故E点X的转化率<F点X的转化率,C项错误;对于吸热反应,温度越高,平衡常数越大,所以F点的平衡常数肯定大于E点的平衡常数,D项正确。
2.答案 C
解析 由图像可知,反应物的总能量小于生成物的总能量,正反应为吸热反应。A项,加入催化剂,焓变不发生变化,A错;B项,该反应前后气体总物质的量不变,加压,化学平衡不移动,B错;C项,正反应吸热,升温,平衡正向移动,C正确;D项,增大H2浓度,虽然平衡正向移动,但达到新平衡时CO的体积分数减小,D错。
3.答案 C
解析 根据图像可知,t1时刻正反应速率突然增大,达新平衡后正反应速率比第一次平衡时低,说明t1时刻逆反应速率减小。A项,t1时降低温度,v正将减小;B项,t1时增大压强,达新平衡后v正应比第一次平衡时大;D项,t1时使用催化剂,v正比第一次平衡时大且保持不变,不可能是改变了温度、压强或使用了催化剂。
4.答案 C
解析 由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错;N点所示溶液为碱性,根据溶液电荷守恒可判断出此时c(Na+)>c(CH3COO-),B错;由于M点的H+浓度等于N点的OH-浓度,对水的电离抑制程度相同,所以两点水的电离程度相同,C正确;Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,故Q点消耗NaOH溶液的体积略小于醋酸溶液的体积,D错。
5.答案 C
解析 A项,依据反应2H2S+SO2===3S↓+2H2O,可算出c(H2S)为0.1 mol·L-1;B项,H2S的酸性比H2SO3的弱;C项,b点溶液为中性,水的电离不受影响,而c点溶液显酸性,水的电离受到抑制;D项,H2S和H2SO3均为二元酸且d点溶液酸性比a点强,故d点溶液导电性强。
6.答案 C
解析 石蕊变色范围宽,不能用作酸碱中和滴定的指示剂,A项错误;①所示溶液抑制水的电离,③所示溶液促进水的电离,B项错误;②点pH=7,根据电荷守恒可得出c(CH3COO-)=c(Na+),C项正确;D项中,电荷不守恒,错误。
7.答案 D
解析 A项,已知K2SO4·MgSO4·2CaSO4(s)2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO(aq),加入饱和NaOH溶液,OH-和Mg2+结合生成Mg(OH)2沉淀,c(Mg2+)减小,平衡右移,正确;B项,加入饱和碳酸钠溶液,CO和Ca2+结合生成CaCO3沉淀,c(Ca2+)减小,平衡右移,正确;C项,由题图可知,升高温度,K+的浸出速率增大,且c(K+)增大,说明平衡正向移动,正确;D项,由方程式可知平衡的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO),错误。
8.答案 C
解析 a~b段,醋酸的电离为吸热过程,电解质溶于水,扩散过程(电离)吸热,水合过程(形成水合离子)放热,A项错误;c~d段,醋酸浓度增大,c(H+)增大,醋酸电离程度减小,越稀越电离,B项错误;c点时,加入等体积等浓度的NaOH溶液,根据物料守恒有c(Na+)=c(CH3COO-)+c(CH3COOH),C项正确;d点时,c(H+)<c(CH3COOH),D项错误。
9.答案 C
解析 根据题意可知,向混合溶液中滴加NaOH溶液,首先生成Fe(OH)3沉淀,即OA段生成Fe(OH)3沉淀,AB段生成Al(OH)3沉淀,二者消耗NaOH溶液的体积比为2∶3,所以原混合溶液中c(Fe3+)∶c(Al3+)=2∶3,A项错误;Fe(NO3)3溶液中混有杂质Al(NO3)3,加入过量的NaOH溶液,Fe3+转化为Fe(OH)3沉淀,得不到Fe(NO3)3溶液,B项错误;当两种沉淀共存时, 由于Ksp[Al(OH)3]=c(Al3+)·c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-),则===2.5×104,C项正确;C点时溶液中的溶质主要有NaAlO2、NaNO3,D项错误。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论