课时6 质量守恒定律 化学方程式
基础巩固
1.(2017龙东地区)实验室用浓盐酸和二氧化锰来制取氯气,反应的化学方程式为:MnO2+4HCl(浓)eq o(=====,s\up7(△)) X+Cl2↑+2H2O,则X的化学式为( )
A.MnCl2 B.ClO2
C.MnCl4 D.HClO
2.下列有关"守恒"的叙述中,正确的是( )
A.镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等
B.在反应3Cu+8HNO3=== 3Cu(NO3)2+2X↑+4H2O中的X的化学式是NO2
C.加热24.5 g KClO3和4 g MnO2的混合物,反应一段时间后,剩余固体24.9 g,则生成O2的质量为3.6 g
D.某纯净物在氧气中燃烧后生成CO2、SO2和CO,该物质中一定含有C、S、O元素
3.(2017大庆改编)下列化学方程式与事实相符的是( )
A.密闭容器中点燃红磷验证质量守恒定律:2P+O2eq o(=====,s\up7(点燃)) P2O5
B.工业上用赤铁矿炼铁:Fe2O3+3CO=== 2Fe+3CO2↑
C.胃酸过多症患者可以服用含氢氧化铝药物进行缓解:Al(OH)3+3HCl=== AlCl3+3H2O
D.葡萄糖在酶的催化作用下经缓慢氧化转变成二氧化碳和水:C6H12O6+6O6=== CO2+6H2O
4.(2017兰州改编)汽车尾气在装有催化剂的净化器中反应的微观过程可用下图表示:
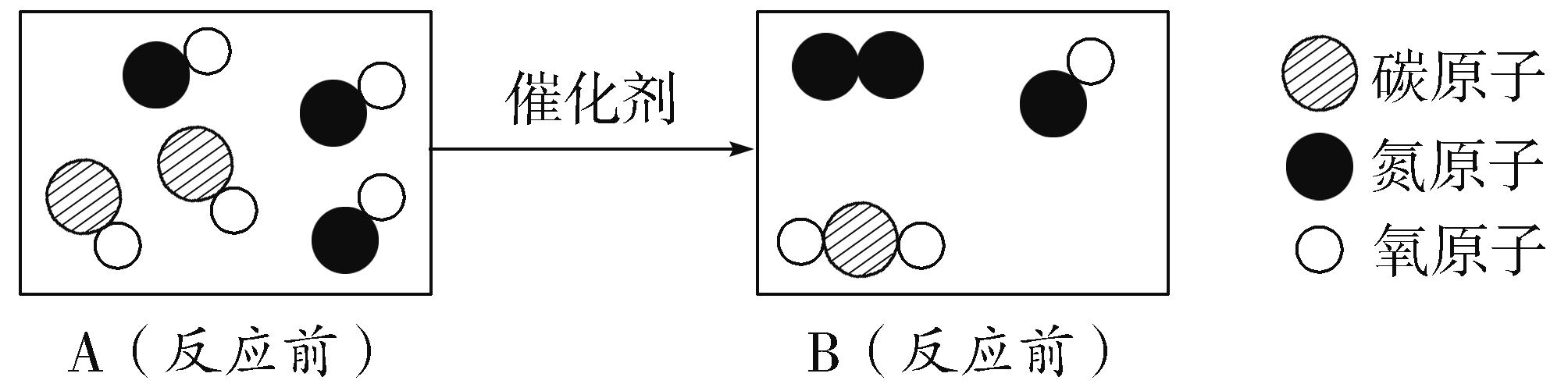
(1)在B中补充画出相关粒子图形,使其表示正确。
(2)该反应中没有发生改变的粒子是__________(填"分子""原子"或"离子")。
(3)写出上述反应的化学方程式:______________________________。
能力提升
5.(2017绥化改编)地质人员考察时发现一种螺纹的矿石。研究发现该矿石能在氧气中燃烧,主要反应是4X+11O2eq o(=====,s\up7(点燃)) 2Fe2O3+8SO2,下列说法正确的是( )
A.该物质的化学式是FeS2
B.该物质由铁、硫、氧三种元素组成
C.参加反应的氧气与生成的二氧化硫的分子个数比为8∶11
D.SO2中硫、氧元素质量比为1∶2
6.根据下列反应事实写出相应的化学式或化学方程式。
(1)交警通过酒精检测仪显示的颜色变化,可快速检测出司机是否酒后驾车,其反应原理为:2CrO3(红色)+3C2H5OH+3H2SO4=== Cr2(SO4)3(绿色)+3CH3CHO+6X,该反应中X的化学式为__________。
(2)氢氧燃料电池是一种新型电池。氧气可从空气中获取,氢气可通过以下反应获取:2NaCl+2H2Oeq o(=====,s\up7(通电)) 2X+Cl2↑+H2↑ 。其中X的化学式是__________。
(3)研究发现,二氧化碳和氢气在催化剂作用下转化为甲醇(CH3OH)和水。该反应的化学方程式为______________________________。
(4)安全气囊中含有叠氮化钠(NaN3)等物质。叠氮化钠在受到猛烈撞击下会分解成两种单质,其中一种是空气中体积分数最大的气体。请写出该反应的化学方程式:________________________________________________________________________。
(5)漂白粉的有效成分是次氯酸钙[Ca(ClO)2],在空气中其溶液能吸收二氧化碳,生成有漂白、杀菌作用的次氯酸(HClO)和一种白色沉淀。请写出该反应的化学方程式:________________________________________________________________________
________________________。
7.(2017泰安)某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如表所示。
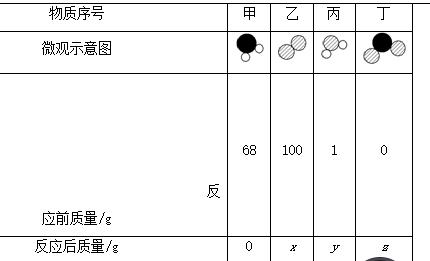
(1)由构成的物质中,所代表的元素的化合价为__________。
(2)表中的四种物质中,属于氧化物的是__________(填化学式)。
(3)上述反应的化学方程式为______________________________。
(4)一位同学在计算x、y和z数值的过程中,列出了以下等式,其中正确的是________(填字母序号)。
A.x+y+z=169 B.y+z=168
C.(100-x)∶z=32∶64 D.(100-x)∶(y-1)=8∶3
8.某同学设计了如图三个实验装置,回答问题:
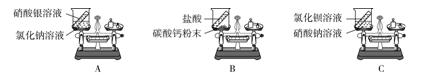
(1)A实验__________(填"能"或"不能")验证质量守恒定律,将两种溶液混合时发生反应的化学方程式为____________________________________。
(2)B实验不能验证质量守恒定律的原因是______________________________,上述实验若试剂不变,应如何改进此装置:____________________________________。
(3)C实验的药品混合前、后质量关系为:m前=m后,某同学却认为该实验不成功,不能验证质量守恒定律,原因是__________________________________。
强化培优
9.一定条件下,3.9 g苯(C6H6)与9.6 g O2恰好完全反应,生成6.6 g CO2、2.7 g H2O和物质X,则X的质量为_________,X的化学式为_________;该反应的化学方程式为_____________________________。
10.现有H2SO4和MgSO4的混合溶液,为了分析混合溶液中H2SO4和MgSO4的质量分数,设计图甲实验方案,并得到图乙有关数据。请回答下列问题:
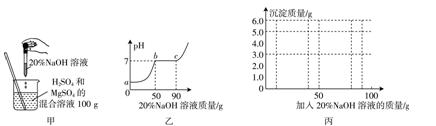
(1)图乙的图像中,ab段表示的是混合溶液中的__________(写化学式)与NaOH发生反应。
(2)与硫酸镁溶液反应的氢氧化钠溶液的质量为__________;请计算该混合溶液中MgSO4的溶质质量分数(写出计算过程)。
(3)在c点,混合溶液与NaOH恰好反应完全,此点溶液中的溶质是__________(写化学式)。
(4)在向100 g混合溶液中不断加入上述氢氧化钠溶液的过程中,请在图丙中画出加入氢氧化钠溶液的质量与产生沉淀质量的关系图。
课时6 质量守恒定律 化学方程式
1.A 2.C 3.C
4.(1) (2)原子 (3)2CO+2NOeq o(=====,s\up7(催化剂)) N2+2CO2
5.A
6.(1)H2O (2)NaOH (3)CO2+3H2eq o(=====,s\up7(催化剂)) CH3OH+H2O
(4)2NaN3eq o(=====,s\up7(撞击)) 2Na+3N2↑
(5)Ca(ClO)2+CO2+H2O=== CaCO3↓+2HClO
7.(1)-2 (2)H2O、SO2 (3)2H2S+3O2eq o(=====,s\up7(点燃)) 2SO2+2H2O (4)AD
8.(1)能 AgNO3+NaCl=== AgCl↓+NaNO3
(2)碳酸钙和盐酸反应生成的二氧化碳气体逸散到空气中 把烧杯换成锥形瓶,锥形瓶的瓶塞上插一个绑有气球的玻璃管
(3)质量守恒定律只适用于化学变化,而C实验中氯化钡溶液与硝酸钠溶液不发生化学反应
9.4.2 g CO C6H6+6O2eq o(=====,s\up7(点燃)) 3CO2+3CO+3H2O
10.(1)H2SO4 (2)40 g
解:设100 g混合液中硫酸镁的质量为x,生成沉淀的质量为y。
MgSO4+2NaOH=== Mg(OH)2↓+Na2SO4
120 80 58
x 40 g×20% y
eq (120,80)=eq (x,40 g×20%),x=12 g;eq (80,58)=eq (40 g×20%,y) ,y=5.8 g
该混合溶液中MgSO4的溶质质量分数是eq (12 g,100 g)×100%=12%
答:该混合溶液中MgSO4的溶质质量分数为12%。
(3)Na2SO4
(4)如下图:
PAGE
/

 加载中,请稍侯......
加载中,请稍侯......
精彩评论