七、盐
1、概念:由金属离子或铵根离子和酸根离子构成的化合物统称为盐。
2、常见的盐见下表。
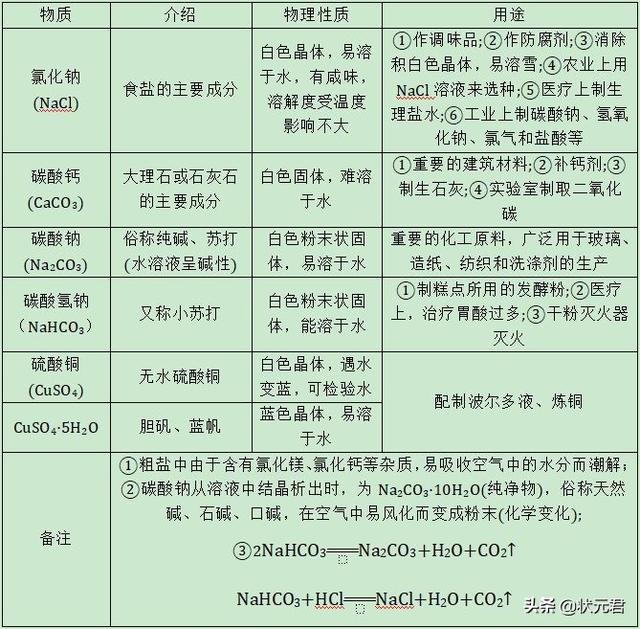
3、粗盐提纯:去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
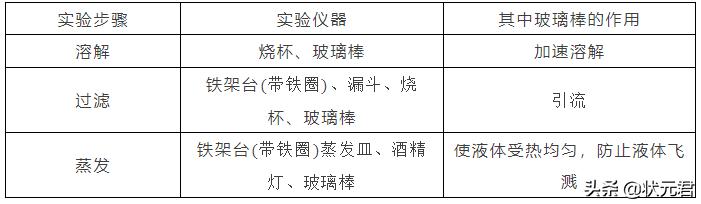
①实验步骤:溶解、过滤、蒸发;
②实验仪器
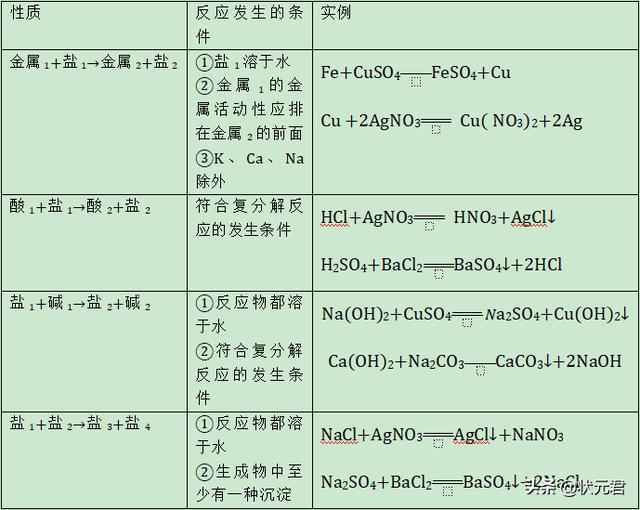
4、盐的化学性质见下表。
历年真题
20.Na2CO3的水溶液呈碱性,下列说法错误的是( )
A.碳酸钠在水中会电离出OH-
B.往碳酸钠溶液中加稀硫酸后溶液的pH降低
C.碳酸钠溶液中存在OH-
D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
21.“比较归纳法”是学习化学的一种重要方法。(“—”表示相连的两种物质能发生反应,“→”表示某种物质可通过一步反应转化为另一种物质)
(1)请以表中序号I为示例,填写序号Ⅱ、Ⅲ中的空格:
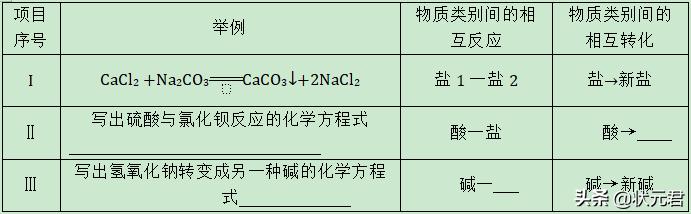
(2)室温下,氯化镁与下列物质的变化关系,正确的是( )
A.MgCl2一AgNO3
B.KNO3→MgCl2
C.MgCl2一HCI
D. Mg(OH)2→MgCl2
22.氨碱法生产纯碱的主要反应原理如下:
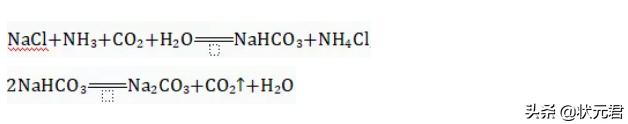
对上述信息的有关理解不正确的是
( )
A.用食盐制纯碱需要含碳、氧元素的物质
B.(1)中析出晶体后只剩一种溶质
C.氨盐水比食盐水更易吸收二氧化碳
D.碳酸氢钠比碳酸钠受热更易分解
23.现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入的量的变化关系如图所示,则X可能是( )
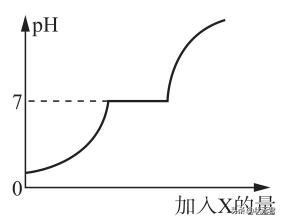
A.水
B.纯碱溶液
C.澄清石灰石
D.稀盐酸
24.粗盐中含有少量不溶性杂质(泥沙)还含有少量可溶性杂质(Na2SO4、CaCl2、MgCl2)。现以粗盐为原料制取精盐,生产过程如图所示。
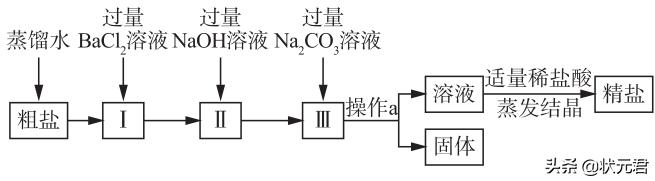
(1)写出I中发生反应的化学方程式 ,加入过量BaCl2溶液的目的是 。
(2)操作a的名称是 ,该操作需要用到的玻璃仪器主要有:烧杯、 、玻璃棒。
(3)加入适量稀盐酸的作用是除去溶液中的 (填化学式)。
(4)在加热蒸发过程中,要用玻璃棒不断地搅拌,其目的是 。
(5)粗盐提纯的步骤是① 、②过滤、③ 、④计算产率。
(6)①、②、③操作中都用到玻璃棒,操作①中用玻璃棒搅拌的作用是 ;过滤操作中玻璃棒的作用是 。
(7)如果过滤操作中的滤液仍然浑浊,应 。
(8)操作③中,当观察到 时,停止加热。
25.下列各组离子在水中能大量共存的是( )
A.Na+、H+、Cl-、HCO3-
B.Na+、K+、NO3-、Cl-
C.H+、Na+、OH-、SO42-
D.Ag+、Ca2+、Cl-、NO3-
26.除去食盐水中的CaCl2和Na2SO4杂质的操作有:
①加过量BaCl2溶液;
②过滤;
③加过量Na2CO3溶液;
④蒸发结晶;
⑤加适量盐酸。
下列操作顺序正确的是(提示:BaSO4、BaCO3难溶于水)( )
A.③①②⑤④
B.①⑤③②④
C.①③⑤④②
D.①③②⑤④
27.小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图所示的所有反应。若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
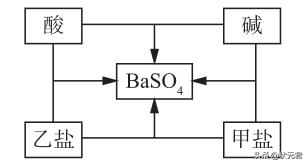
A.HCI NaOH BaCl2 Na2SO4
B.HCI Ba(OH)2 Na2SO4 BaCl2
C.H2SO4 Ba(OH)2 Na2SO4 BaCl2
D. H2SO4 NaOH BaCl2 Na2SO4
28.有A、B、C三瓶失去标签的无色溶液,它们分别是盐酸、澄清石灰水和碳酸钠溶液中的一种。为了鉴别它们,各取少量溶液两两混合,实验结果如下表所示。表中“↓”表示有沉淀产生;“↑”表示有气体产生;“一”表示观察不到明显的现象变化。
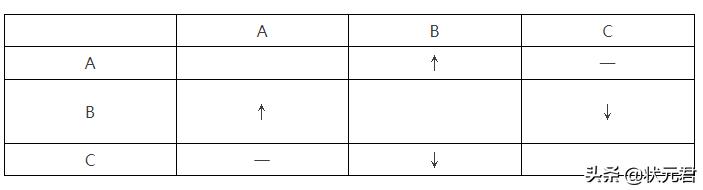
回答下列问题:
(1)A中溶质的化学式是 ,A与C反应的基本类型是 ;
(2)A与B、B与C反应的化学方程式分别是 、 。
29.我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
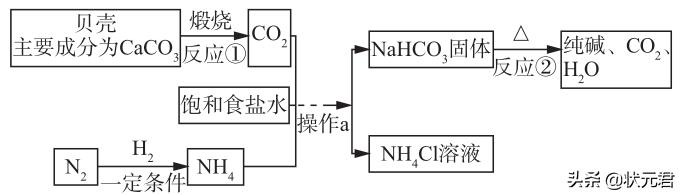
(1)反应①的化学方程式 ,反应②的基本反应类型为 。
(2)工业上用分离液态空气的方法制取氮气,属于 变化(填“物理”或“化学”)
(3)操作a的名称是 ,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、 。
(4)写出NH4Cl的一种用途: 。
30.食盐是一种重要的化工原料。请回答下列问题:
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。

①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和 。
②在蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必必须将粗盐进行精制,流程见下图。
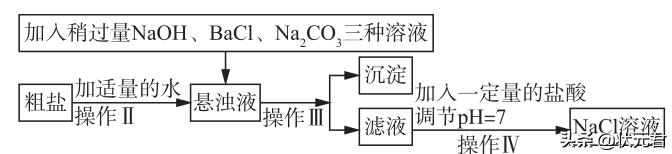
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是 (用化学方程式表示)
②通过操作Ⅲ所得滤液中的溶质有 (用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100kg,要将其变成20℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。(已知:20℃时氯化钠的溶解度为36g)
八、化学肥料
1、农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构。
2、化学肥料(氮肥、钾肥、磷肥)
(1)氮肥
作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗)。缺氮:叶黄。
①氮肥
常用氮肥有碳酸氢铵( NH4HCO3)、硝酸铵(NH4NO3)、硫酸铵[(NH4)2SO4]、尿素[CO(NH2)2]、氨水[NH3·H2O]。
②NH4+的检验
试剂:碱[NaOH、Ca(OH)2等]、湿润的红色石蕊试纸
NH4NO3+NaOH=NaNO3+NH3↑+
H2O
③生物固氮:豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收。
(2)钾肥
作用:促使作物生长健壮、茎秆粗硬,抗倒伏(壮秆)。缺钾:叶尖发黄。
常用钾肥:KCl、草木灰(主要成分为K2CO3、呈碱性)、K2SO4(长期使用会使土壤酸化、板结)。
(3)磷肥作用:促进植物根系发达,穗粒增多,饱满(催果)。缺磷:生长迟缓,产量降低,根系不发达。
种类:磷矿粉Ca3(PO4)2、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙Ca(H2PO4)2和CaSO4的混合物。
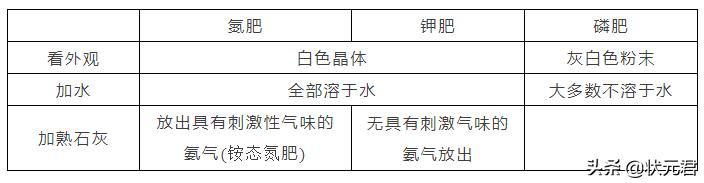
拓展:三种化肥的区别方法
(4)复合肥:含N、P、K中的两种或三种,如KNO3、NH4H2PO4、(NH4)2HPO4等。
3、化肥的不合理使用会造成污染
(1)土壤污染:重金属元素、有毒有机物、放射性物质。
(2)大气污染:N2O、NH3、H2S。
(3)引起水体污染:N、P过多,导致水体富营养化,赤潮、水华等现象。
4、合理使用化肥
根据土壤情况和农作物种类选择化肥;农家肥和化肥合理配用。
历年真题
31.复合肥可以为农作物提供多种营养元素,下列化学肥料属于复合肥的是( )
A Ca(H2PO4)2
B.KNO3
C. K2SO4
D.CO(NH2)2
32.下列有关化肥和农药的说法错误的是( )
A.氯化钾可用作钾肥
B.化肥能有效提高农作物产量
C.农药施用后,不会通过农作物转移到人体
D.农药应根据农作物、虫害和农药的特点合理施用
33.随着世界人口的增长,人类对农产品的需求量增大,化肥对农作物的增产已成为最有力的措施。现有一包化肥,可能是碳酸氢铵、硫酸铵、磷矿粉、氯化钾中的一种,取盐少量样品,观察到外观为白色固体,加水后能全部溶解;另取少量样品与熟石灰混合研磨,没有刺激性气体放出,这包化肥是( )
A.碳酸氢铵
B.氯化钾
C.硫酸铵
D.磷矿粉
34.某化肥说明书的一部分如图所示。

(1)此包化肥中含氮的质量为 kg。
(2)该化肥的化学性质为:
①与碱性物质混用会因放出 气而损失肥效;
② 。
(3)该化肥的物理性质为 。
参考答案
1.①滴瓶
②红色
(2)碱性;<;
2.D
3.(1)分子的间隔
(2)①固体溶解,溶液由无色变为浅绿色,有气泡产生
②H+ Cl- Fe2+
③B、C

7.B
8.(1)O2
(2)HN+5O3
(3)H+
9.(1)Cu(OH)2、CO2
(2)Na2CO3(碳酸钠);有气泡(气体)产生
10.A
11.D
12.A
13.D
14.D
15.C


31.B
32.C
33.B
34.(1)8.0
(2)①氨;②受热易分解
(3)易溶于水

 加载中,请稍侯......
加载中,请稍侯......
精彩评论