考纲要求
1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
2.能根据微粒(原子、分子、离子等)数目、物质的量、气体体积(标准状况下)之间的相互关系进行有关计算。
考点一 物质的量 摩尔质量
1.物质的量

2.摩尔质量

小贴士:

有些高一的同学容易混淆概念,一定要注意这两个小贴士,反复去理解,就像练功一样,这样都是高深的功法秘籍。
考点二 气体摩尔体积 阿伏加德罗定律

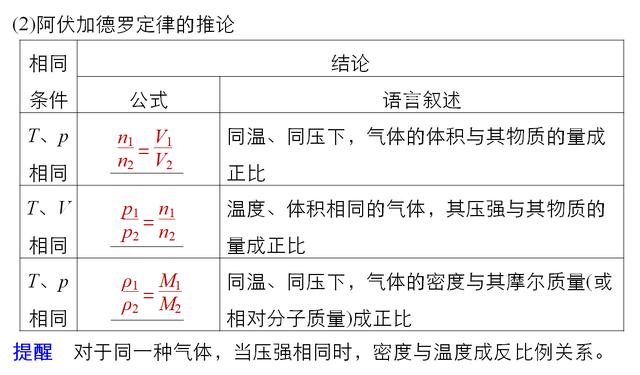
这里说几点,首先要注意的是气体,这个大前提,出题人往往会在这里挖个坑,一定要审题仔细,如标况下,18g的H2O为22.4L,这个说法就是错误的,标况下H2O并不是气体,是液体。
其次是标况条件,在0℃,101KPa的条件,记住不是常温也不是25℃。
最后,这些公式都在建立在气理想气体标准方程的,感兴趣的同学可以自行百度,或者拿这个去问问授课老师。
方法总结

考点三 突破阿伏加德罗常数应用的陷阱

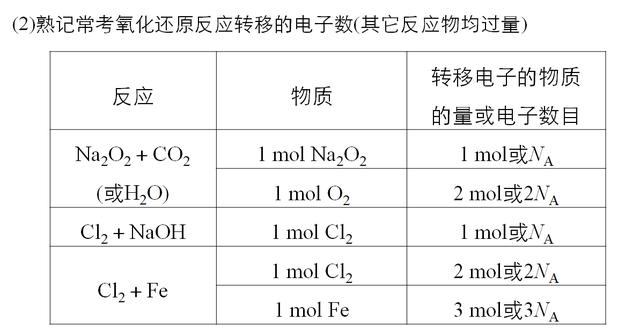
物质的量,是高中化学的入门基础,以后有关于化学的计算以及计量数问题,全是基于物质的量,因此很多高一的同学,刚开始接触的时候,会觉得难以理解,这毕竟是宏观到微观的一个过渡,需要多练习多思考。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论