题组一 电化学原理及应用
[答题模板]
答题模板,分析思路(要点)(1)判断装置,看有无外接电源,有电源的为电解池,无电源的为原电池(2)确定电极名称,原电池:负极发生氧化反应
电解池:与直流电源的正极相连的是阳极,发生氧化反应(3)写电极反应式,电极材料是否参与电池反应;电解质溶液是否参与电池反应;电解质溶液是否与电极产物反应(4)计算,串联装置中各电极得失电子的总数相等[挑战满分](限时20分钟)
1.如图所示的装置中,金属片紧贴着滤纸,下列判断错误的是( )
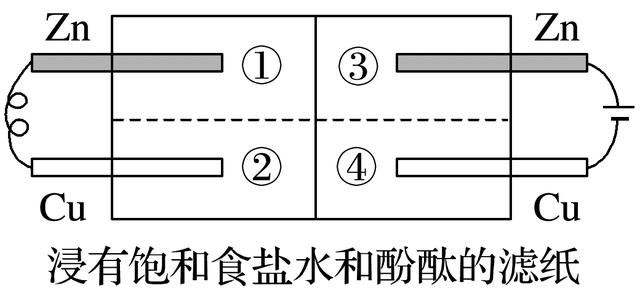
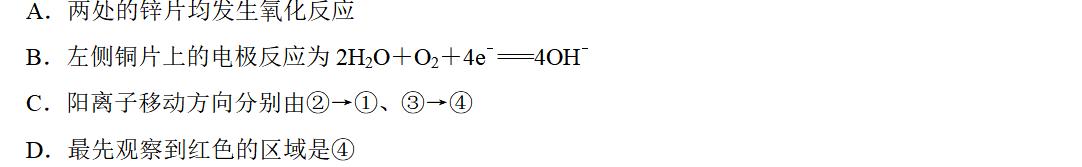
答案 C
解析 左边是原电池,锌作负极被氧化,铜作正极,铜电极上发生吸氧腐蚀:O2+2H2O+4e-===4OH-,B正确;右边是电解池,锌作阳极被氧化,铜作阴极2H++2e-===H2↑使④处呈碱性(速率快于②),A、D正确;左侧阳离子移动方向是由①→②,C错误。
2.我国科学家设计出的一种装置(如图所示),实现了"太阳能→电能→化学能"的转化,总反应为2CO2===2CO+O2。下列有关说法正确的是( )

答案 B
解析 该装置实现了太阳能→电能→化学能的转化,而将电能转化为化学能属于电解池,A项错误;由图可知Y极发生的是得电子的反应,人体呼出的气体中含有CO2和H2O,B项正确;由得失电子守恒原理知,X极消耗的OH-总量等于Y极生成的OH-总量,即电解质溶液的碱性没有改变,C项错误;从电子的流向看,X电极失去电子,故X电极是负极,电极反应式为4OH--4e-===2H2O+O2↑,D项错误。
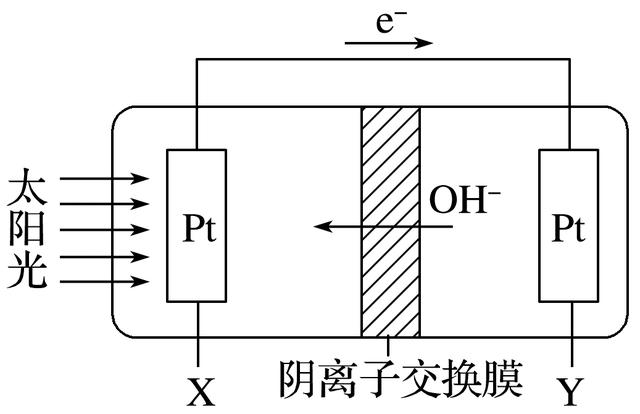
3.锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )

答案 D
解析 正极的反应式为O2+4e-+2H2O===4OH-,A项错误;电池充电时,阴极发生还原反应,B项错误;有机电解液不能用稀盐酸代替,因为金属锂与稀盐酸能发生反应,C项错误。
4.电化学在日常生活中用途广泛,下图是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O===Cl-+Mg(OH)2↓。下列说法不正确的是( )
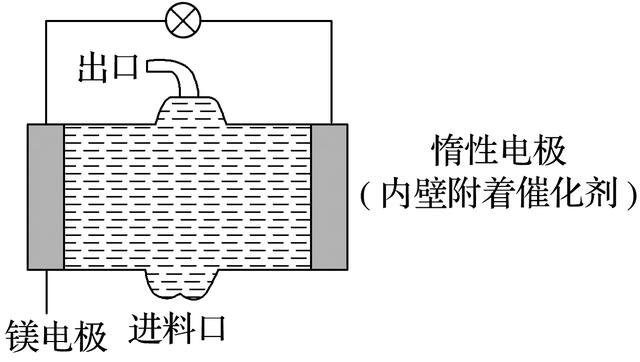
答案 B
解析 根据化学方程式知Mg是还原剂作负极,ClO-在惰性电极上得电子发生还原反应,生成Cl-。
5.Al—H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是( )
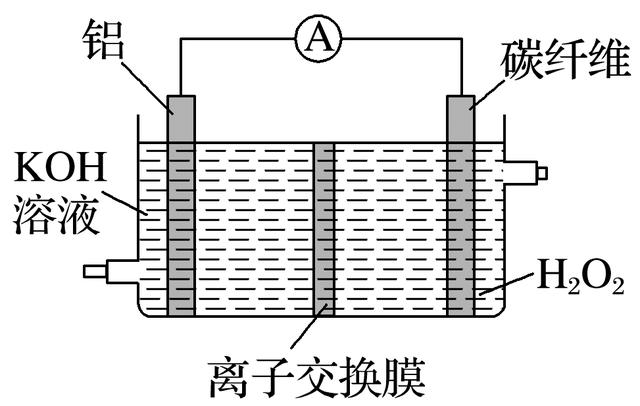

答案 C
解析 该电池的负极为铝,正极是碳纤维,A项正确;该电池不是二次电池,不能充电,B项正确;电解质溶液为KOH溶液,电极反应式中无H+,C项错误;电池工作时,阴离子移向负极,D项正确。
6.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是( )
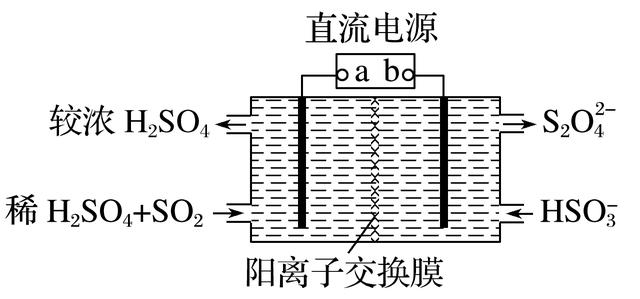

答案 C
解析 由装置左侧反应可知,电极上SO2发生反应后生成H2SO4,电极反应式为SO2-2e-+2H2O===SO+4H+,为电解池的阳极,故a极为电源的正极,A项错误,C项正确;在阴极上HSO得电子生成S2O,根据两者中S的化合价可知,1molHSO得到1mol电子,B项错误;电解池中阳离子由阳极室通过离子交换膜进入到阴极室,D项错误。
7.利用下图装置进行实验,甲、乙两池中均为1mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )
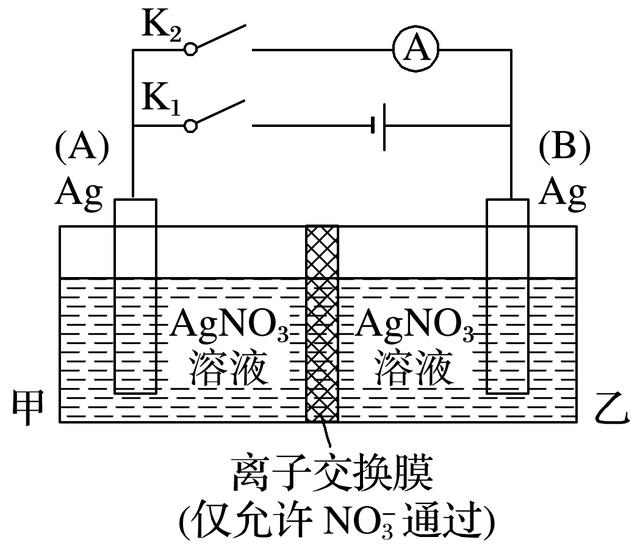
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,NO向B电极移动
D.断开K1,闭合K2后,A电极发生氧化反应
答案 C
解析 闭合K1,断开K2,构成电解池,阴极(A)析出银,质量增加,阳极(B)溶解使银离子浓度增大,甲池中NO移向乙池,A、B正确;断开K1,闭合K2后形成原电池,乙池银离子浓度大,氧化性强,故B为正极,A为负极,阴离子向负极移动,A极发生氧化反应,C错误,D正确。
8.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子,乳酸的摩尔质量为90g·mol-1)。下列有关说法中正确的是( )
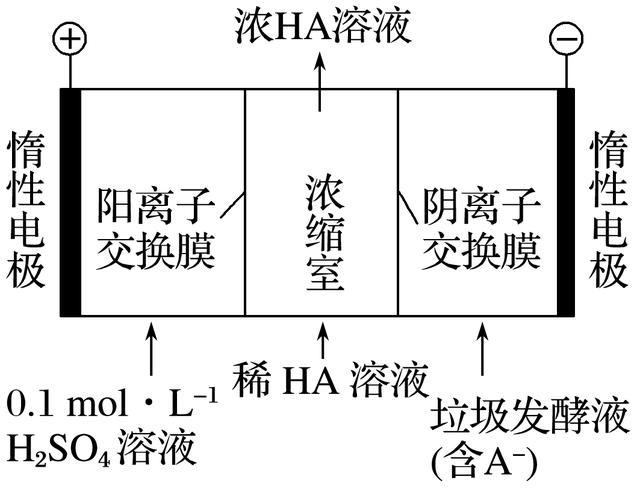

答案 C

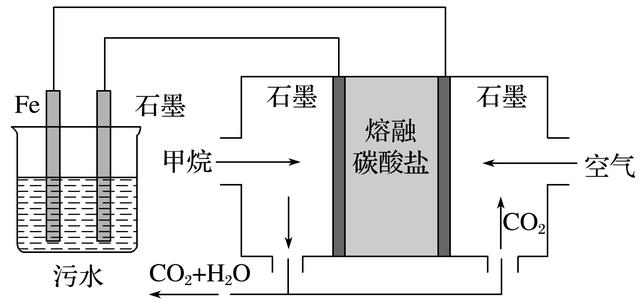
9.电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是( )


题组二 溶液中的离子平衡
[解题指导]
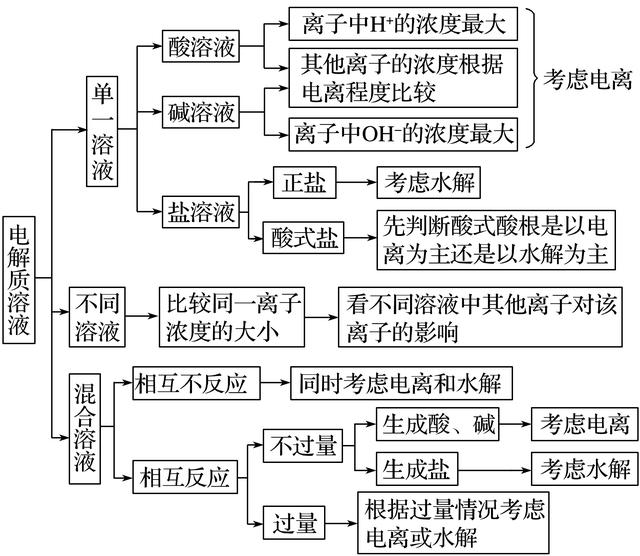
比较溶液中粒子浓度的思维模型
[挑战满分](限时15分钟)
1.下列选项中的数值前者小于后者的是( )
A.25℃和100℃时H2O的Kw
B.同温同浓度的KHCO3溶液和NH4HCO3溶液中的c(HCO)
C.同温同浓度的NaHCO3溶液和CH3COONa溶液的pH
D.中和25mL0.1mol·L-1NaOH溶液所需CH3COOH和HCl的物质的量
答案 A
解析 NH4HCO3中NH与HCO相互促进水解,使c(HCO)浓度比KHCO3中的小,B项错误;由酸性CH3COOH大于H2CO3知,HCO的水解程度比CH3COO-的水解程度大,溶液的pH前者大于后者,C项错误;中和25mL0.1mol·L-1NaOH溶液所需CH3COOH和HCl物质的量相等,D项错误。
2.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
答案 D
解析 pH=5的H2S溶液中,存在H2SHS-+H+,HS==S2-+H+,所以c( H+)>c(HS-),A项错误;因为NH3·H2O为弱碱,稀释10倍,pH改变小于1个单位,所以a<b+1,B项错误;当草酸与氢氧化钠溶液混合后,溶液中还存在C2O,C项错误;根据CH3COOH、HClO、H2CO3的酸性相对强弱可以确定三种溶液的浓度大小,D项正确。
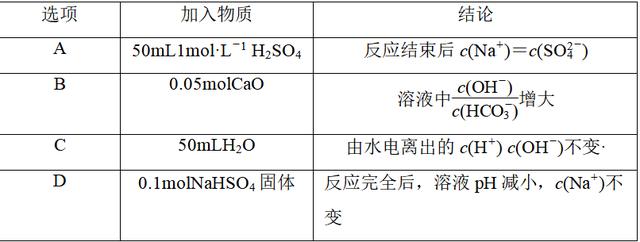
3.室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
答案 B
解析 Na2CO3溶液中存在水解平衡CO+H2OHCO+OH-,所以溶液呈碱性。A项,向溶液中加入50mL1mol·L-1H2SO4,Na2CO3与H2SO4恰好反应生成0.05molNa2SO4,根据物料守恒可得c(Na+)=2c(SO),错误;B项,向Na2CO3溶液中加入0.05molCaO后,发生反应CaO+H2O===Ca(OH)2,生成0.05molCa(OH)2恰好与Na2CO3反应:Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,则c(CO)减小,c(OH-)增大,c(HCO)减小,所以
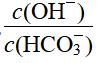
增大,正确;C项,加入50mLH2O,CO的水解平衡正向移动,但c(OH-)减小,溶液中的OH-全部来源于水的电离,由水电离出的H+、OH-浓度相等,故由水电离出的c(H+)·c(OH-)减小,错误;D项,加入的0.1molNaHSO4固体与0.05molNa2CO3恰好反应生成0.1molNa2SO4,溶液呈中性,故溶液pH减小,加入NaHSO4,引入Na+,所以c(Na+)增大,错误。
4.足量的NaHSO3溶液和Na2CO3溶液混合后能产生CO2气体。下列说法正确的是( )
A.反应的离子方程式为2H++CO===H2O+CO2↑
B.若向Na2CO3溶液中通入足量SO2气体,也可得到CO2
C.HSO的水解程度大于其电离程度
D.K1(H2SO3)>K1(H2CO3)>K2(H2SO3)>K2(H2CO3)
答案 B
解析 亚硫酸是弱酸,故在离子方程式中"HSO"应作为一个整体来书写,A错误;由生成CO2知亚硫酸氢钠溶液呈酸性,HSO的电离程度大于其水解程度,C错误;因HSO能将CO转化为CO2,这说明亚硫酸的二级电离常数大于碳酸的一级电离常数,D错误。
5.若保持温度不变,向氨水中通入一定量HCl气体,下列会减小的是( )
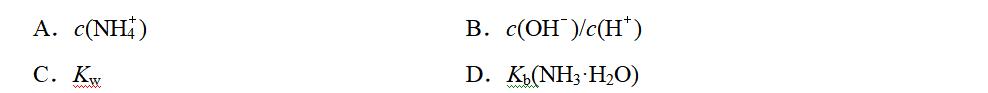
答案 B
解析 氨水中存在平衡:NH3·H2O===NH+OH-,通入HCl后消耗OH-,平衡右移,c(NH)增大,c(OH-)减小,c(H+)增大,Kw、Kb(NH3·H2O)均不变。
6.下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
答案 A
解析 B项中c(Cl-)=c(NH);C项中CH3COOH消耗NaOH的量多;D项中c(OH-)增大。
7.下列叙述正确的是( )
A.0.1mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
答案 D
解析 乙酸钠是强碱弱酸盐,溶液为碱性,A错误;温度不变,Kw不变,B错误;pH相等,则溶液中c(H+)相等,C错误;硫化银溶解度小于AgCl,当加入AgCl固体时,AgCl沉淀会转化为Ag2S,c(S2-)下降,D正确。
8.已知Ksp[Al(OH)3]≪Ksp[Mg(OH)2]。在含等物质的量浓度的Al(NO3)3、Mg(NO3)2的混合溶液中滴加NaOH溶液。下列离子方程式书写正确的是( )
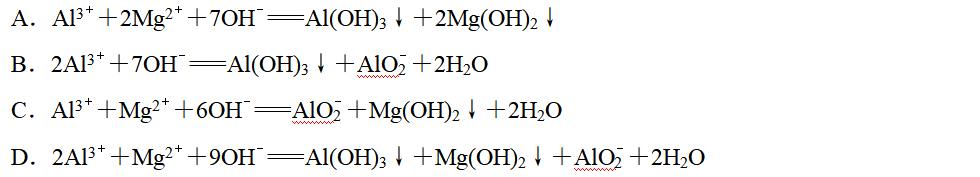
答案 C
解析 审题时抓住两条信息:一是溶度积大小;二是金属离子浓度相等。依题意,与NaOH溶液反应的先后顺序为Al3+>Mg2+>Al(OH)3。A项,Al3+未完全生成沉淀,Mg2+不会生成Mg(OH)2沉淀,错误;B项,Mg2+没有生成沉淀,不会生成AlO,正确的离子方程式为Al3++Mg2++6OH-===Mg(OH)2↓+AlO+2H2O,错误;D项,Mg2+完全生成沉淀后,Al(OH)3才开始转化成AlO,错误。
9.25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )

答案 D

10.Na2SO3溶液作为吸收液吸收SO2时,吸收液pH随n(SO)∶n(HSO)变化的关系如下表:
n(SO)∶n(HSO),91∶9,1∶1,9∶91pH,8.2,7.2,6.2以下离子浓度关系的判断正确的是( )
A.NaHSO3溶液中,c(H+)<c(OH-)
B.Na2SO3溶液中,c(Na+)>c(SO)>c(HSO)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO)>c(HSO)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)>c(HSO)+c(SO)
答案 D
解析 用Na2SO3溶液吸收SO2时,随着吸收SO2的量增多,溶液由碱性逐渐变为酸性。由表中信息可知NaHSO3溶液为酸性溶液,A错误;Na2SO3溶液中SO存在二级水解,c(HSO)应小于c(OH-),B错误;由表中数据可知,当c(SO)=c(HSO)时,pH=7.2,故当吸收液呈中性时,可推出c(SO)<c(HSO),C错误。
题组三 图像题专项突破
[解题指导]
1.审题
观察图像时,一定要看清楚两坐标的具体含义,明确图像中各曲线的意义,注意各曲线上出现的拐点、特殊点、起点、终点表示的含义。
2.析题
根据题中、图中信息,明确涉及哪些化学反应原理,如涉及化学反应,写出可能发生反应的化学方程式或离子方程式,并与相关数据结合起来,有效地做到数形结合。
3.解题
(1)在识图像、想原理的基础上,将图像与原理结合起来思考,找准切入点。
(2)一是任何条件下,只要溶液中c(H+)=c(OH-),一定呈中性;二是溶液中电荷一定守恒。
4.检查
最后要对试题进行认真检查核对,避免失误。
[挑战满分](限时20分钟)
1.在一定条件下,取一定量X和Y在恒容密闭容器中发生反应:aX(g)+bY(g)==cM(g)+dN(g) ΔH=QkJ·mol-1,达到平衡时,M的浓度与温度和容器容积的关系如图所示。下列判断正确的是( )
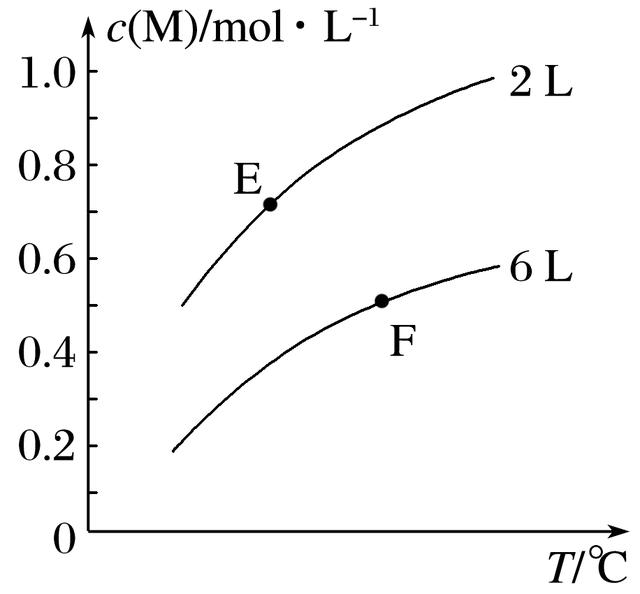
A.a+b>c+d
B.Q<0
C.E点X的转化率>F点X的转化率
D.E点的平衡常数<F点的平衡常数
答案 D
解析 容器容积不变的情况下,随着温度的升高,M的平衡浓度逐渐增大,说明平衡正向移动,正反应为吸热反应,故Q>0,B项错误;在同温度下,比较两条曲线上某两个点,比如就比较两个曲线的起点,可知当容器容积缩小到原来的三分之一时,M的平衡浓度没有增大到原来的三倍(0.6mol·L-1),而是0.5mol·L-1,说明平衡逆向移动了,故a+b<c+d,A项错误;由E点到F点,温度升高、压强减小,这两个改变条件均有利于平衡正向移动,故E点X的转化率<F点X的转化率,C项错误;对于吸热反应,温度越高,平衡常数越大,所以F点的平衡常数肯定大于E点的平衡常数,D项正确。
2.一定条件下,密闭容器中发生如下反应:CO2(g)+H2(g)==CO(g)+H2O(g),反应中的能量变化如图所示。下列说法正确的是( )
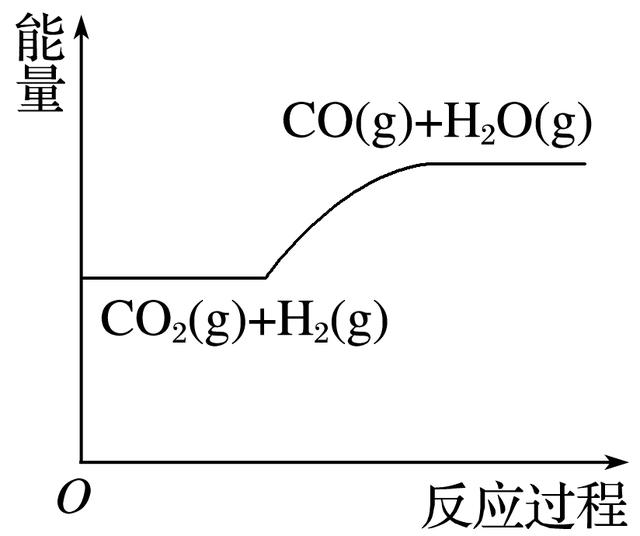
A.反应体系中加入催化剂可增大焓变
B.加压可使化学平衡正向移动
C.升温可使化学平衡正向移动
D.增大H2浓度可使达到新平衡时CO的体积分数增大
答案 C
解析 由图像可知,反应物的总能量小于生成物的总能量,正反应为吸热反应。A项,加入催化剂,焓变不发生变化,A错;B项,该反应前后气体总物质的量不变,加压,化学平衡不移动,B错;C项,正反应吸热,升温,平衡正向移动,C正确;D项,增大H2浓度,虽然平衡正向移动,但达到新平衡时CO的体积分数减小,D错。
3.如图表示可逆反应N2(g)+3H2(g)==2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是( )
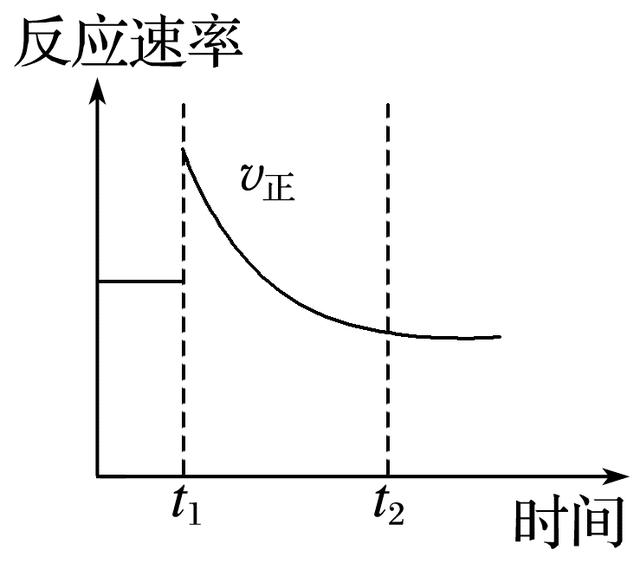
A.t1时降低了温度,平衡向正反应方向移动
B.t1时增大了压强,平衡向正反应方向移动
C.t1时增大了N2的浓度同时减小了NH3的浓度,平衡向正反应方向移动
D.t1时可能使用了催化剂
答案 C
解析 根据图像可知,t1时刻正反应速率突然增大,达新平衡后正反应速率比第一次平衡时低,说明t1时刻逆反应速率减小。A项,t1时降低温度,v正将减小;B项,t1时增大压强,达新平衡后v正应比第一次平衡时大;D项,t1时使用催化剂,v正比第一次平衡时大且保持不变,不可能是改变了温度、压强或使用了催化剂。
4.某温度下,向一定体积0.1mol·L-1醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )
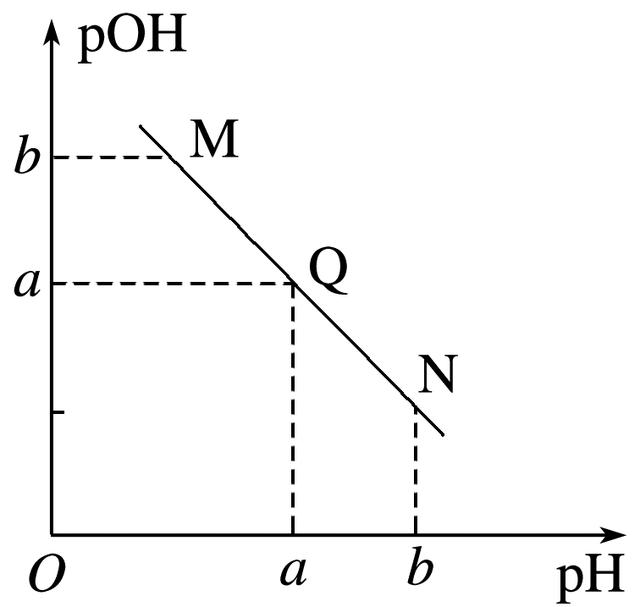
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
答案 C
解析 由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错;N点所示溶液为碱性,根据溶液电荷守恒可判断出此时c(Na+)>c(CH3COO-),B错;由于M点的H+浓度等于N点的OH-浓度,对水的电离抑制程度相同,所以两点水的电离程度相同,C正确;Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,故Q点消耗NaOH溶液的体积略小于醋酸溶液的体积,D错。
5.标准状况下,向100mLH2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是( )
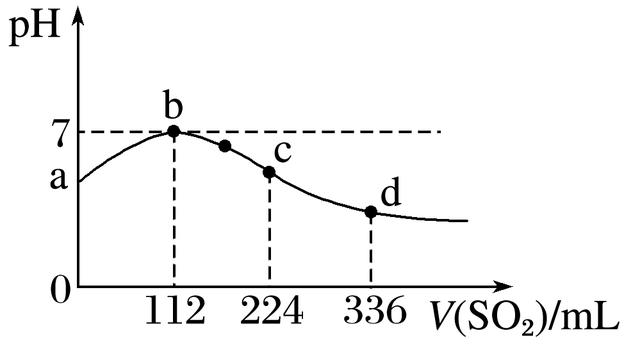
A.原H2S溶液的物质的量浓度为0.05mol·L-1
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
答案 C
解析 A项,依据反应2H2S+SO2===3S↓+2H2O,可算出c(H2S)为0.1mol·L-1;B项,H2S的酸性比H2SO3的弱;C项,b点溶液为中性,水的电离不受影响,而c点溶液显酸性,水的电离受到抑制;D项,H2S和H2SO3均为二元酸且d点溶液酸性比a点强,故d点溶液导电性强。
6.在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中正确的是( )
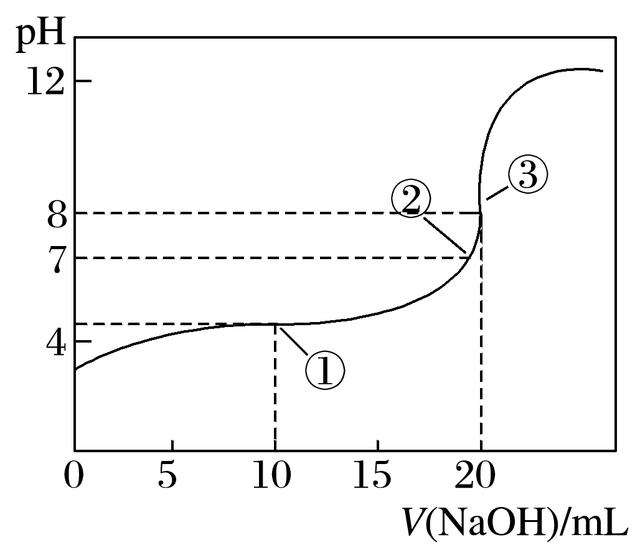
A.该中和滴定过程,最宜用石蕊作指示剂
B.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度
C.图中点②所示溶液中,c(CH3COO-)=c(Na+)
D.滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在
答案 C
解析 石蕊变色范围宽,不能用作酸碱中和滴定的指示剂,A项错误;①所示溶液抑制水的电离,③所示溶液促进水的电离,B项错误;②点pH=7,根据电荷守恒可得出c(CH3COO-)=c(Na+),C项正确;D项中,电荷不守恒,错误。
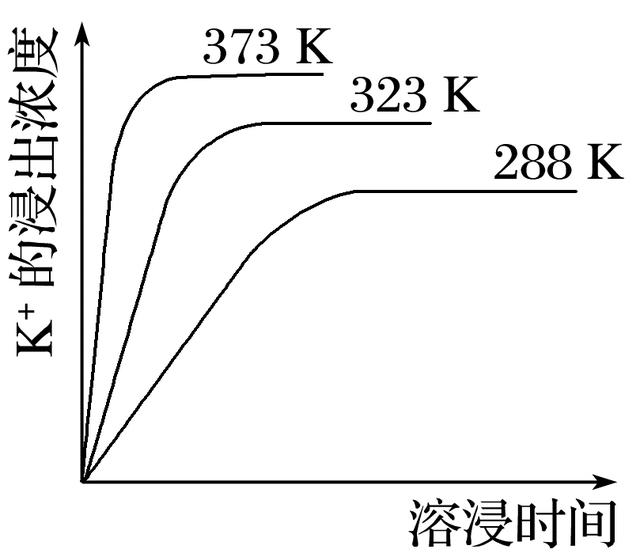
7.已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)==2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO(aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是( )
A.向该体系中加入饱和NaOH溶液,沉淀溶解平衡向右移动
B.向该体系中加入饱和碳酸钠溶液,沉淀溶解平衡向右移动
C.升高温度,反应速率增大,平衡向正反应方向移动
D.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO)
答案 D
解析 A项,已知K2SO4·MgSO4·2CaSO4(s)==2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO(aq),加入饱和NaOH溶液,OH-和Mg2+结合生成Mg(OH)2沉淀,c(Mg2+)减小,平衡右移,正确;B项,加入饱和碳酸钠溶液,CO和Ca2+结合生成CaCO3沉淀,c(Ca2+)减小,平衡右移,正确;C项,由题图可知,升高温度,K+的浸出速率增大,且c(K+)增大,说明平衡正向移动,正确;D项,由方程式可知平衡的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO),错误。
8.室温下,将10.00mL5.00mol·L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随醋酸体积变化的曲线如图所示。下列有关说法正确的是( )
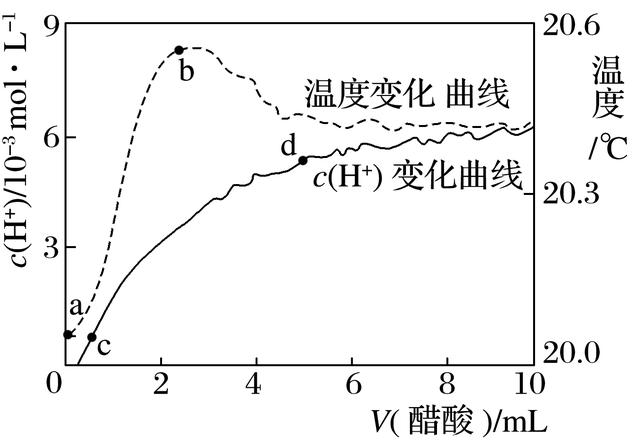
A.a~b段,醋酸的电离为放热过程
B.c~d段,c(H+)增大,醋酸电离度增加
C.c点时,加入等体积等浓度的NaOH溶液,则:
c(Na+)=c(CH3COO-)+c(CH3COOH)
D.d点时,c(H+)>c(CH3COOH)
答案 C
解析 a~b段,醋酸的电离为吸热过程,电解质溶于水,扩散过程(电离)吸热,水合过程(形成水合离子)放热,A项错误;c~d段,醋酸浓度增大,c(H+)增大,醋酸电离程度减小,越稀越电离,B项错误;c点时,加入等体积等浓度的NaOH溶液,根据物料守恒有c(Na+)=c(CH3COO-)+c(CH3COOH),C项正确;d点时,c(H+)<c(CH3COOH),D项错误。
9.已知:25℃时,Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液的体积的关系如图所示。当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列说法正确的是( )
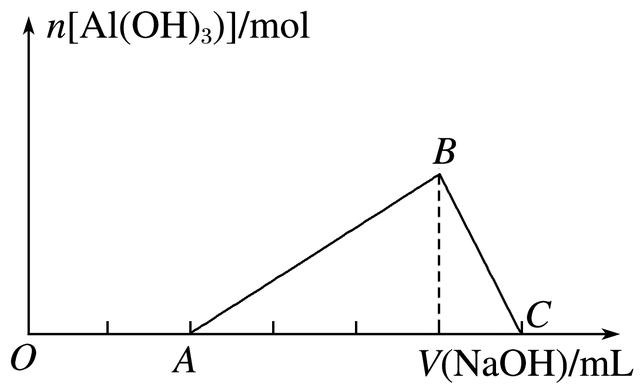
A.原混合溶液中c(Fe3+)∶c(Al3+)=1∶1
B.若Fe(NO3)3溶液中混有杂质Al(NO3)3,可以加入过量的NaOH溶液除去
C.B点两种沉淀共存,此时上层溶液中c(Al3+)∶c(Fe3+)=2.5×104
D.C点溶液中的溶质只有NaAlO2
答案 C


 加载中,请稍侯......
加载中,请稍侯......
精彩评论