命题点18 质量守恒定律
(时间:40分钟 分值:37分)
一、选择题
1. (2016安顺)双氧水分解生成水和氧气的反应前后,发生改变的是( )
A. 元素种类 B. 原子种类
C. 分子种类 D. 原子数目
2. (2016龙东)科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃料,其燃烧时的主要反应为4NH3+3O2eq o(=====,s\up7(一定条件)) 2X+6H2O,则X的化学式为( )
A. N2 B. NO C. NO2 D. N2O
3. (2016安徽十校联考四)如图是密闭体系中某反应的微观示意图,"

"和"

"分别表示两种不同元素的原子。下列说法错误的是( )
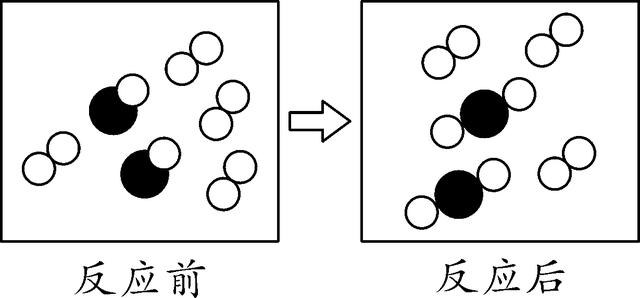
A. 参加反应的"

"和"

"个数比为1∶2
B. 反应前后原子种类没有改变
C. 反应后该密闭体系中没有单质存在
D. 该反应是化合反应
4. (2016邵阳)某化学反应可表示为:二氧化碳+水→M+氧气。根据以上信息,下列关于M组成的说法中正确的是( )
A. 一定含有C、H元素,可能含有O元素
B. 只含有C、H元素
C. 含有C、H、O三种元素
D. 无法确定
5. (2016河南)偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为:C2H8N2+2N2O4=== 2X↑+3N2↑+4H2O↑。下列说法正确的是( )
A. X的化学式为CO
B. 偏二甲肼中碳的质量分数为40%
C. 该反应属于分解反应
D. 生成N2和H2O的质量比为14∶9
6. (2016合肥38中一模)如图是一定条件下某反应的微观示意图,说法错误的是( )
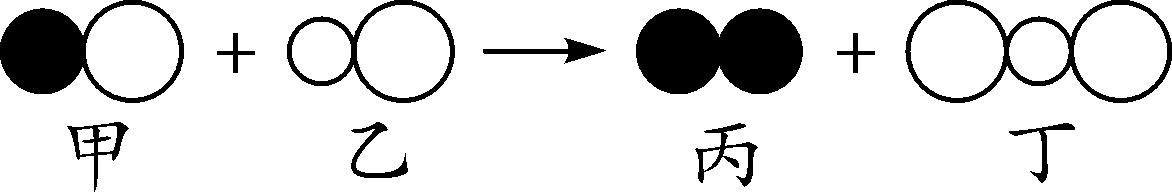
A. 该反应是置换反应
B. 反应中甲、乙两种物质的分子数之比为1∶1
C. 反应前后原子种类、数目不变
D. 反应物和生成物都是由分子构成的
7. (2016包河区二模)某两种物质在一定条件下会发生化学反应,其反应的微观示意图如下,则下列说法正确的是( )
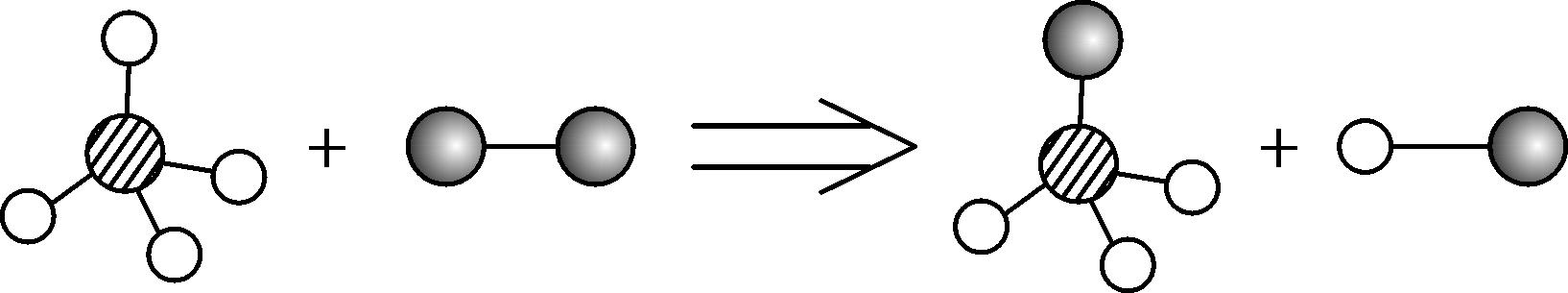
A. 该反应前后分子、原子个数都不变
B. 该反应中各物质均为化合物
C. 该反应不符合质量守恒定律
D. 该反应为置换反应
8. (2016安庆一模)如图是工业生产水煤气的化学反应微观示意图,有关叙述错误的是( )
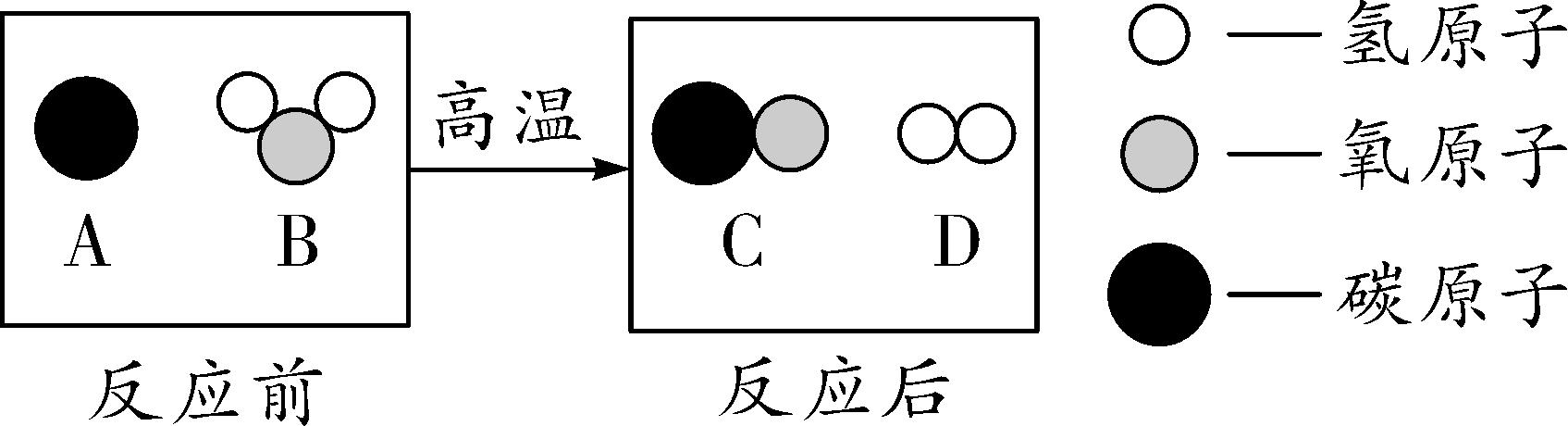
A. 该反应是置换反应
B. 图中气体单质的化学式为H2
C. 反应后原子的个数减少
D. 水煤气泄漏会污染空气
9. (2016蚌埠九中一模)乙烯(C2H4)是有机化工生产中的重要原料,如图是乙烯和水反应的微观模拟图,关于该反应说法正确的是( )
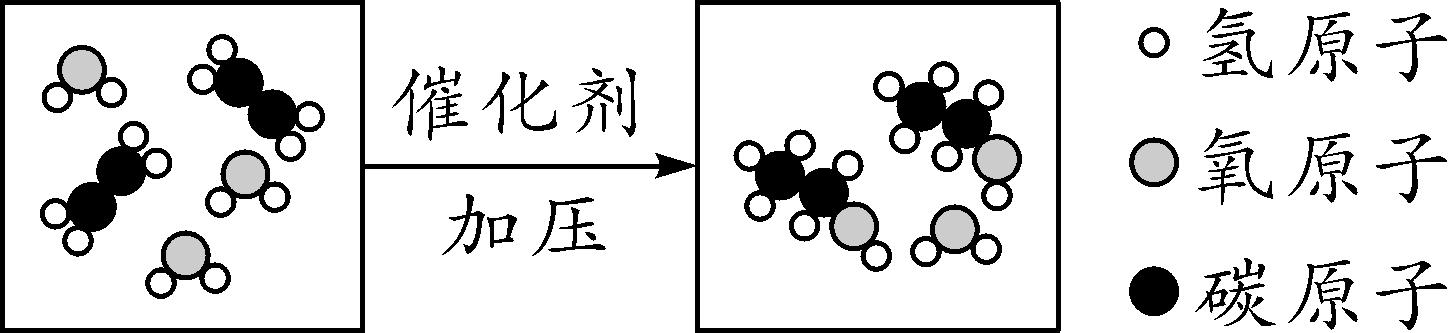
A. 反应前后催化剂的性质改变
B. 属于化合反应
C. 参加反应的乙烯分子和水分子个数比为2∶3
D. 生成物为氧化物
10. (2016随州)在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。根据表中信息判断下列说法正确的是( )
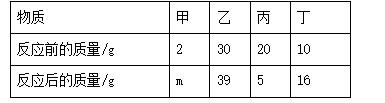
A. 该反应是化合反应
B. 甲是该反应的催化剂
C. 反应过程中乙、丙变化的质量比为3∶5
D. 丙可能是单质
11. (2016眉山)在一密闭容器内加入甲乙丙丁四种物质,在一定条件下充分发生化学反应,测得反应前后各物质的质量变化如图。下列说法中错误的是( )
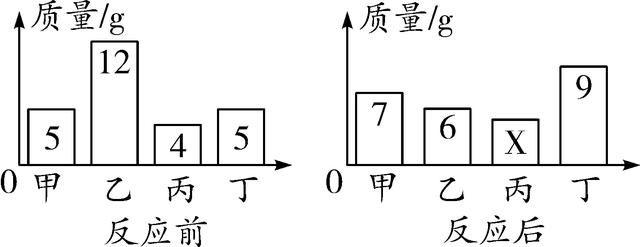
A. 丙可能为该反应的催化剂
B. 该反应中丁、乙质量变化之比为2∶3
C. 反应后图中的X=4
D. 该反应为化合反应
12. 一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示。下列说法正确的是( )
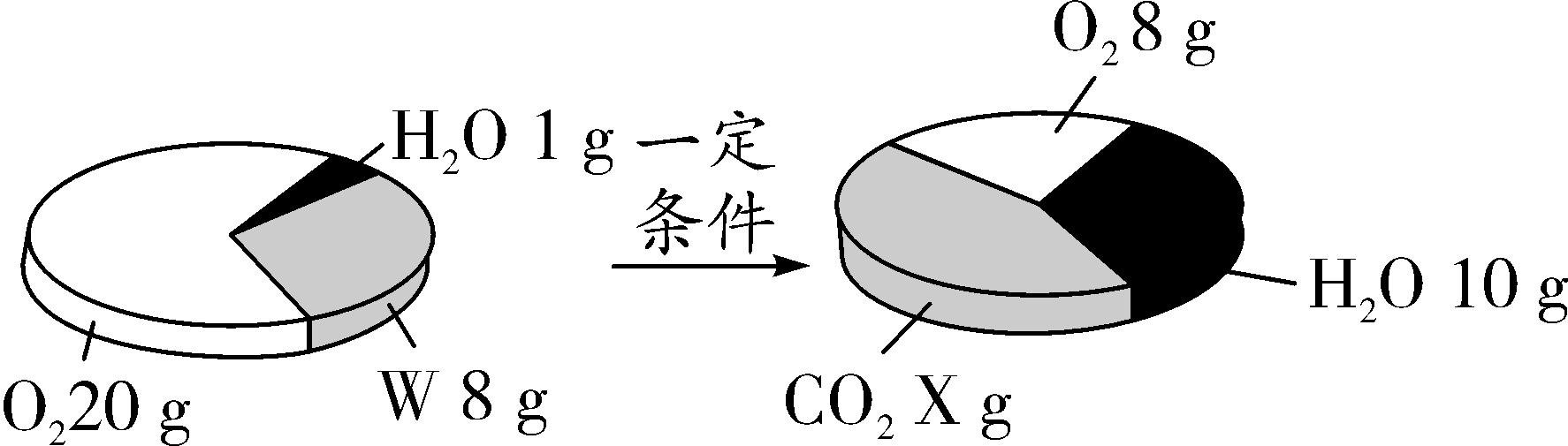
A. X的值为22
B. 该反应属于置换反应
C. W由碳、氢两种元素组成
D. W中碳、氢元素原子个数比为1∶4
13. 三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示。下列说法正确的是( )
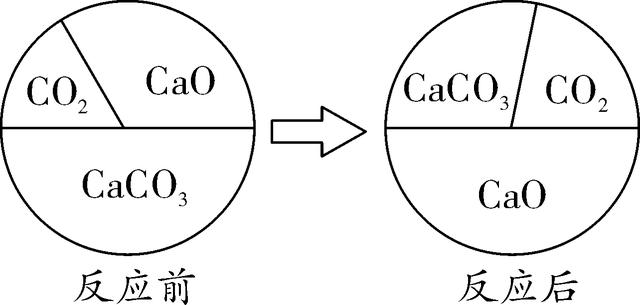
A.反应中CaO为催化剂
B.该反应是复分解反应
C.反应后容器中固体质量减少
D.反应后容器中氧元素质量分数增大
14. (2016金华)如图为某化学反应的微观过程,两个甲分子反应生成二个乙分子和一个丙分子,则从图示获得的信息中,正确的是( )
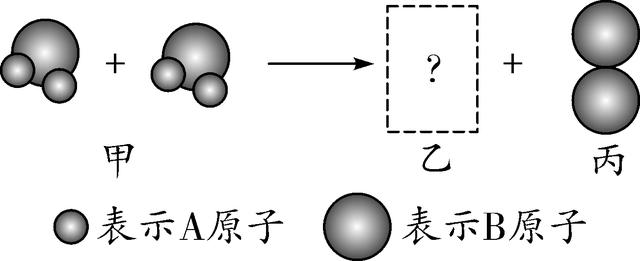
A. 该反应的生成物乙属于单质
B. 该反应中反应物不可能是氧化物
C. 该反应的基本类型属于复分解反应
D. 该反应前后各元素的化合价均不变
15. (2016黄冈)已知M、N在一定条件下,能发生反应:M+2N=== P+2Q,则下列说法中不正确的是( )
A. 若M、N、P、Q都是由分子构成的物质,则该反应前后分子的数目一定不变
B. M、N、P、Q可能含有同一种元素
C. 若P、Q都是化合物,则该反应一定是复分解反应
D. 若16 g M和64 g N能恰好完全反应,则M、N的相对分子质量之比为1∶2
二、填空和简答题
16. (2016孝感)以下是老师引导学生探究"质量守恒定律"的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等;猜想2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
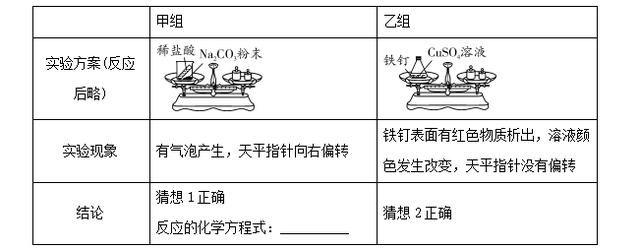
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在____________中进行。
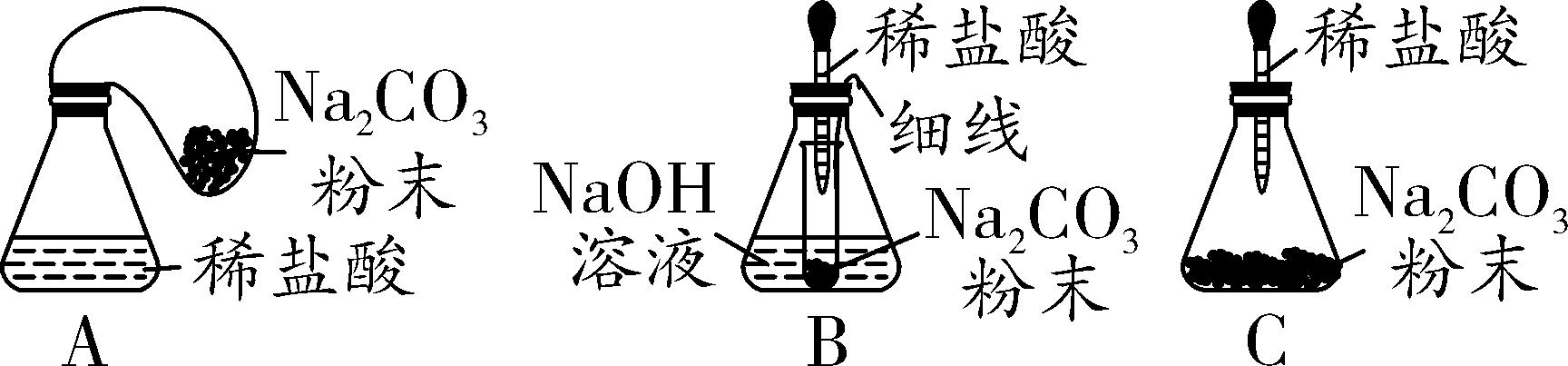
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是________(填序号),从另外两种装置中任选一种指出其不足____________________________。
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:____________________的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由________种元素组成。
答案
1. C 【解析】双氧水是过氧化氢,过氧化氢分解生成水和氧气,发生化学变化,化学变化中元素的种类、原子的种类及数目不变,分子的种类一定改变。故选C。
2. A 【解析】根据化学反应前后原子的种类和数目不变,可列表分析确定X的化学式:
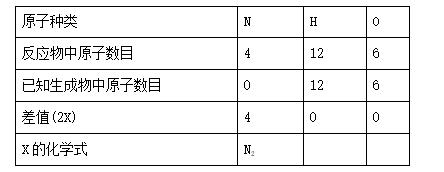
3. C 【解析】
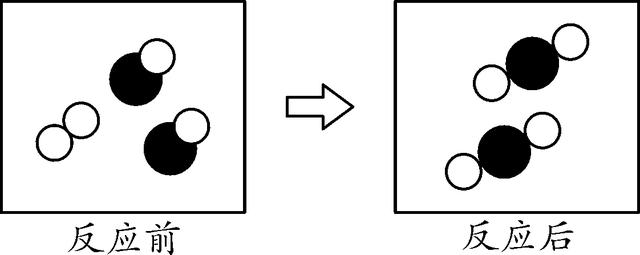
将反应前后都有的分子剔除(即删去没有参加反应的分子),该反应的微观示意图如图,所以参加反应的两种原子的个数比为1∶2,A正确;反应前后原子的种类不变,B正确;根据图示,反应后还有没有参加反应的单质分子,C错误;该反应的反应物有两种,生成物只有一种,该反应属于化合反应,D正确。
4. A 【解析】根据质量守恒定律,化学反应前后,元素的种类不变,原子的个数不变。反应物质中含有C、H、O三种元素,已知生成物质中只含有O元素,故M中一定含有C、H元素,可能含有O元素。
5. B 【解析】根据质量守恒定律,化学反应前后原子种类及个数不变,推出X的化学式是CO2,A错误;偏二甲肼(C2HgN2)中碳的质量分数为eq (12×2,12×2+1×8+14×2)×100%=40%,B正确;由于该反应中反应物有两种,所以不是分解反应,C错误;生成N2和H2O的质量比为(3×28)∶(4×18)=7∶6,D错误。
6. A 【解析】
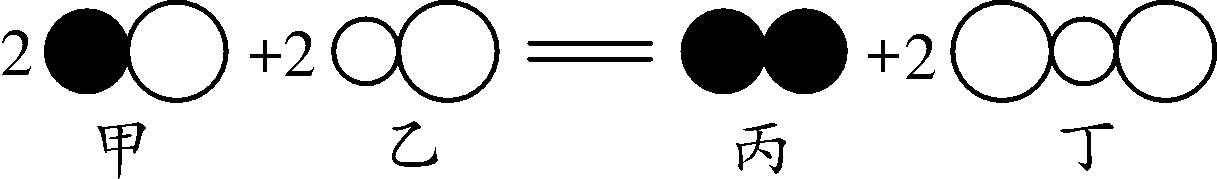
置换反应是一种单质与一种化合物生成另一种单质和另一种化合物的反应,该反应中反应物均为化合物,所以该反应不是置换反应,A错误;该反应配平后,可表示为如图所示,所以反应中甲、乙的分子数目之比为1∶1,B正确;反应前后原子的种类和数目不变,C正确;该反应的反应物和生成物均由分子构成,D正确。
7. A 【解析】化学反应中原子的种类和数目均不变,该反应中反应前分子数目为2,反应后分子数目仍然为2,所以反应前后分子数目不变,A正确;该反应的反应物一种是单质,一种是化合物,B错误;该反应遵守质量守恒定律,C错误;置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,该反应中反应物为一种单质和一种化合物,但生成物中没有单质,所以该反应不属于置换反应,D不正确。
8. C 【解析】该反应可表示为C+H2Oeq o(=====,s\up7(高温)) CO↑+H2↑,所以该反应为置换反应,A正确;生成物中D为氢气,属于单质,B正确;化学反应前后原子的种类及个数不变,C不正确;一氧化碳有毒,是空气污染物,D正确。
9. B 【解析】催化剂在化学反应前后化学性质不变,A不正确;图示反应用化学方程式表示为C2H4+H2Oeq o(=====,s\up7(催化剂),sdo5(加压)) C2H5OH,所以该反应属于化合反应,B正确;参加反应的乙烯分子与水分子的个数比为1∶1,C不正确;氧化物是由两种元素组成,且其中一种元素是氧元素的化合物,该生成物由三种元素组成,不属于氧化物,D不正确。
10. C 【解析】根据化学反应中反应物的质量减少,生成物的质量增加,可确定丙是反应物,且参加反应的质量为15 g,乙、丁为生成物,生成的质量分别为9 g、6 g;根据质量守恒定律中反应物的质量等于生成物的质量,可确定m=2;反应的表达式为丙→乙+丁。该反应为分解反应,A错误;甲的质量在反应前后不变,可能是反应的催化剂也可能是不参加反应的杂质,B错误;反应过程中乙、丙变化的质量比为9 g∶15 g=3∶5,C正确;该反应是分解反应,丙是反应物,不会是单质,一定是化合物,D错误。
11. D 【解析】根据质量守恒定律,化学反应前后物质总质量不变可得5 g+12 g+4 g+5 g=7 g+6 g+X g+9 g,解得X=4,丙的质量没有改变,可能是该反应的催化剂,也可能是不参加反应的杂质,A正确、C正确;该反应中甲、丁的质量增加,乙的质量减少,说明该反应是乙分解生成甲和丁,属于分解反应,D错误;丁、乙质量变化之比为(9 g-5 g)∶(12 g-6 g)=2∶3,B正确。
12. D 【解析】根据质量守恒定律,反应前后物质的总质量不变,可以得出X的质量是:(20 g+1 g+8 g)-(8 g+10 g)=11 g;根据反应前后各物质的含量可以看出反应后W、氧气的质量减少,是反应物;水和二氧化碳的质量增加,是生成物,且生成水的质量是9 g;该反应的生成物是两种化合物,不属于置换反应;根据质量守恒定律:反应前后元素的种类不变,可知W中一定含有碳氢元素,碳氢元素的质量就是生成二氧化碳中的碳元素和水中氢元素的质量之和,11 g二氧化碳中碳元素的质量为11 g×eq (12,44)×100%=3 g;9 g水中氢元素的质量为9 g×eq (2,18)=1 g,因此8 gW中含有碳、氢、氧三种元素。其中碳氢原子个数比为eq (3 g,12) ∶eq (1 g,1)=1∶4;故选D。
13. C 【解析】

A 【解析】

15. C 【解析】通过化学方程式可以得出,该反应是1个M分子和2个N分子反应生成1个P分子和2个Q分子,故反应前后分子的数目一定不变,A正确;M、N、P、Q中可能含有同一种元素,如:H2SO4+2NaOH=== Na2SO4+2H2O,B正确;若P、Q都是化合物,该反应不一定是复分解反应,如:CH4+2O2eq o(=====,s\up7(点燃)) CO2+2H2O,C错误;设M和N的相对分子质量分别为a、b,则a ∶2b=16 g ∶64 g,解得a ∶b=1 ∶2,D正确。
16. 【实验探究】Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
【反思评价】密闭容器(或封闭体系等合理即可)
【优化装置】B A装置中反应产生气体,气球膨胀,浮力增大,导致称量结果不准(或C装置中反应产生气体,瓶内气压增大,可能导致瓶塞迸出)
【得出结论】参加化学反应(或参加反应)
【解释应用】四(或4或C、H、O、Cu)
【解析】【实验探究】碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,参加反应的碳酸钠与氯化氢的质量之和等于生成的氯化钠、水和二氧化碳的质量之和,因有二氧化碳气体逸出,故反应后总质量比反应前总质量减少,观察到天平不平衡;反应的方程式为Na2CO3+2HCl=== 2NaCl+H2O+CO2↑。【反思评价】通过讨论,同学们发现甲组中有气体逸出,导致天平指针向右偏转,得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在密闭容器中进行。【优化装置】最佳装置是B,A同学实验中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大,会加速生成CO2,导致瓶内气压增大,因此反应后天平不能平衡。C中碳酸钠粉末与盐酸反应太快,橡皮塞易弹出。【得出结论】参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。【解释应用】因为化学反应前后元素的种类不变,氧化铜、二氧化碳和水含有铜、碳、氧、氢四种元素,所以该化合物中也会含有这四种元素

 加载中,请稍侯......
加载中,请稍侯......
精彩评论