考点一 离子共存
7.(2016江苏单科,12,4分)制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、N、Cl-、S2-
B.加入少量NaClO溶液:N、Fe2+、H+、S2-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、N03-、S2-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、S2-、Cl-、ClO-、OH-
答案 D A项,通入过量的Cl2,Fe2+不能大量存在;B项,ClO-在酸性环境中不能大量存在,Fe2+与ClO-因发生氧化还原反应而不能大量共存;C项,在碱性环境中,Fe2+、N不能大量存在。
8.(2014江苏单科,3,2分)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、Mn、CO32-
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、S2-、NO3-
C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl-
D.0.1 mol·L-1 FeCl3溶液中:Fe2+、NO3-、SCN-、S2-
答案 C pH=1的溶液中C不能大量存在,A项不符合题意;c(H+)=1×10-13 mol·L-1的溶液为强碱性溶液,Cu2+、Mg2+不能大量存在,B项不符合题意;Fe3+和SCN-不共存,D项不符合题意。
9.(2013广东理综,8,4分)水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、Mn2+
C.K+、Ca2+、Cl-、NO3- D.K+、NO3-、OH-、S2-
答案 C A项,Al3+水解显酸性,C水解显碱性,互相促进水解生成Al(OH)3沉淀和CO2气体;B项,Mn在酸性条件下具有强氧化性,可以与Fe2+发生氧化还原反应;D项,N与OH-不能大量共存。
10.(2013江苏单科,3,2分)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、S2-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1 mol·L-1 AgNO3溶液:H+、K+、S2-、I-
D.0.1 mol·L-1 NaAlO2溶液:H+、Na+、Cl-、S2-
答案 A A项中的溶液显酸性,在酸性条件下,各离子能大量共存;B项中的溶液显碱性,在碱性条件下,Cu2+、HC不能大量存在;C项中的Ag+与I-、S不能大量共存,同时在有H+存在的条件下,N能氧化I-;D项中的Al与H+不能大量共存。
11.(2012安徽理综,8,6分)下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是( )
A.K+、Ca2+、Cl-、N03- B.K+、Na+、Br-、SiO32-
C.H+、Fe2+、S2-、Cl2 D.K+、Ag+、NH3·H2O、NO3-
答案 A B项,通入CO2后发生反应:SiO32-+CO2+H2O

H2SiO3↓+C;C项,Cl2能够氧化Fe2+;D项,Ag+和NH3·H2O可以发生反应:Ag++NH3·H2O
Ag(OH)↓+NH4+,氨水过量还可以发生反应:AgOH+2NH3·H2O== Ag(NH3)2OH+2H2O。
12.(2012江苏单科,3,2分)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、S032-、Co32-
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NO3-、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、No3-
答案 A B项,Ba2+与C不能大量共存;C项,Fe3+与SCN-因生成配合物而不能大量共存,Fe3+与I-因发生氧化还原反应也不能大量共存;D项,c(H+)/c(OH-)=1×1014的溶液呈强酸性,ClO-不能大量存在。
考点二 离子方程式的书写正误判断
7.(2016江苏单科,5,2分)下列指定反应的离子方程式正确的是( )
A.将铜丝插入稀硝酸中:Cu+4H++2No3-== Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe== 2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O== Al(OH)3↓+3No3-
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
答案 C A项,铜与稀硝酸反应生成NO,故错误;B项,电荷不守恒、得失电子不守恒,故错误;C项,Al(OH)3不溶于氨水,故正确;D项,Na2SiO3能溶于水且完全电离,应拆开,故错误。
8.(2015北京理综,11,6分,★★)某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-==ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2O
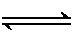
HClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-==Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-==HClO+CH3COO-
答案 B A项,用NaOH溶液吸收Cl2可以制备NaClO,即Cl2+2OH-===Cl-+ClO-+H2O;B项,饱和NaClO溶液的pH约为11是因为ClO-水解,该消毒液的pH约为12是因为消毒液中含有NaOH;C项,消毒液中的ClO-和洁厕灵中的Cl-在酸性条件下发生氧化还原反应产生Cl2;D项,白醋中的CH3COOH可以和NaClO发生复分解反应生成HClO,增强消毒液的漂白作用。
9.(2015江苏单科,9,2分)下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+ H2O==2H++Cl-+ClO-
B.Na2CO3溶液中C的水解:CO32-+H2O== HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+====I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=== BaCO3↓+H2O
答案 D A项,HClO是弱酸,不能拆,正确的离子方程式为Cl2+H2O===H++Cl-+HClO;B项,正确的离子方程式为CO32-+H2O====HCO3-+OH-;C项,方程式两边电荷不守恒,正确的离子方程式为IO3-+5I-+6H+===3I2+3H2O;D项正确。
10.(2013江苏单科,8,2分)下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl
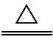
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O==Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O=== 2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HC+Ca2++OH-==CaCO3↓+H2O
答案 D A项,HCl是强电解质,应拆写为离子形式,A项错误;B项,正确的离子方程式为Al3++3H2O== Al(OH)3(胶体)+3H+,B项错误;C项,正确的离子方程式为2Na2O2+2H2O ==4Na++4OH-+O2↑,C项错误;D项正确。评析 本题主要考查离子方程式的书写。本题易错选B,原因是忽略了Al3+的水解反应是可逆的,且产物不是Al(OH)3沉淀,而是Al(OH)3胶体。酸式盐与强碱的反应,应按"以少定多"的原则书写离子方程式,即先将少量物质中实际参加反应的离子按化学式的组成写出,过量物质实际参加反应的离子数目根据少量物质离子的消耗来确定。
11.(2012全国,7,6分)能正确表示下列反应的离子方程式是( )
A.硫酸铝溶液中加入过量氨水 Al3++3OH-===Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-== CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=== ClO-+Cl-+H2O
D.稀硫酸中加入铁粉 2Fe+6H+=== 2Fe3++3H2↑
答案 C A项,NH3·H2O属于弱电解质,应写成化学式,A项错误;B项,Ca(OH)2应拆写成离子形式,B项错误;D项,铁与稀硫酸反应生成Fe2+,正确的离子方程式为Fe+2H+==Fe2++H2↑,D项错误。
12.(2012海南单科,12,4分)能正确表示下列反应的离子方程式为 ( )
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=== CO32-+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH- ==SO42-+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+=== H2S↑+Ba2+
D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-==2AlO2-+H2O
答案 BD A中忽略了碳酸钙的生成;C中忽略了硫酸钡的生成。
13.(2011课标,12,6分)能正确表示下列反应的离子方程式为( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+== Fe2++H2S↑
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-== CO32-+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O ==C6H5OH+HS-
D.大理石溶于醋酸中:CaCO3+2CH3COOH=== Ca2++2CH3COO-+CO2↑+H2O
答案 D A项,FeS被稀硝酸氧化为Fe3+和S;B项,漏掉了N与OH-的反应;C项,少量SO2通入苯酚钠溶液中,产物为C6H5OH和S;D项,正确。

 加载中,请稍侯......
加载中,请稍侯......
精彩评论